Une pneumopathie interstitielle diffuse révélant un syndrome des antisynthétases: à propos de 2 cas
Nizar El Bouardi, Amina Alaoui, Meriem Haloua, Youssef Lamrani, Meryem Boubbou, Mustapha Maaroufi, Baderdine Alami
Corresponding author: Nizar El Bouardi, Service de Radiologie, Centre Hospitalo-Universitaire Hassan II, Fès, Maroc 
Received: 11 Dec 2018 - Accepted: 15 Jan 2019 - Published: 22 Jan 2019
Domain: Radiology,Pulmonology
Keywords: Syndrome des antisynthétases, pneumopathie infiltrante diffuse, anti-Jo1, pronostic
©Nizar El Bouardi et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Nizar El Bouardi et al. Une pneumopathie interstitielle diffuse révélant un syndrome des antisynthétases: à propos de 2 cas. Pan African Medical Journal. 2019;32:40. [doi: 10.11604/pamj.2019.32.40.17903]
Available online at: https://www.panafrican-med-journal.com//content/article/32/40/full
Original article 
Une pneumopathie interstitielle diffuse révélant un syndrome des antisynthétases: à propos de 2 cas
Une pneumopathie interstitielle diffuse révélant un syndrome des antisynthétases: à propos de 2 cas
Diffuse interstitial lung disease revealing anti-synthetase syndrome: about two cases
Nizar El Bouardi1,2,&, Amina Alaoui1,2, Meriem Haloua1,2, Youssef Lamrani1,2, Meryem Boubbou1,2, Mustapha Maaroufi1,2, Baderdine Alami1,2
1Service de Radiologie, Centre Hospitalo-Universitaire Hassan II, Fès, Maroc, 2Faculté de Médecine et de Pharmacie, Université Sidi Mohamed Ben Abdellah, Fès, Maroc
&Auteur correspondant
Nizar El Bouardi, Service de Radiologie, Centre Hospitalo-Universitaire Hassan
II, Fès, Maroc
Le syndrome des antisynthétases (SAS) est une myopathie inflammatoire fréquemment associée à une atteinte pulmonaire, surtout parenchymateuse (pneumopathie infiltrante diffuse). Les manifestations extrathoraciques associées à l'atteinte pulmonaire peuvent orienter le diagnostic: myalgies, polyarthralgies, syndrome de Raynaud, hyperkératose érythémateuse palmaire fissuraire et fièvre. Devant un tableau clinique et radiologique évocateur, la présence d'anticorps anti-ARN-t synthétases permet de confirmer notamment les anti-Jo-1. L'atteinte pulmonaire constitue un facteur pronostic majeur d'où l'indication une thérapie immunosuppressive intensive fondée sur la corticothérapie, les immunosuppresseurs ou l'association des deux. Une meilleure sensibilisation pour cette affection à révélation pulmonaire permettra d'adopter une prise en charge rapide et adéquate, et d'améliorer par conséquent le pronostic.
English abstract
Anti-synthetase syndrome (ASS) is an inflammatory myopathy commonly associated with pulmonary involvement, especially parenchymal (diffuse infiltrative pneumonitis). Extrathoracic manifestations associated with pulmonary involvement can give an indication to the diagnosis: myalgias, polyarthralgias, Raynaud's syndrome, erythematous palmar hyperkeratosis with fissures and fever. Given the suggestive clinical and radiological picture, the presence of aminoacyl-transfer RNA (tRNA) synthetase antibodies enables to confirm, in particular, Anti Jo-1 antibody activity. Pulmonary involvement is a major prognostic factor, hence the indication for intensive immunosuppressive therapy based on corticosteroids, immunosuppressive medications or the association among them. A better awareness about this disorder revealed by pulmonary manifestations could enable early and adequate management and to improve patient's prognosis.
Key words: Antisynthetases syndrome, diffuse infiltrative lung disease, anti-Jo-1, prognosis
Le syndrome des antisynthétases est une myopathie inflammatoire primaire rare qui est caractérisée par l'association d'une myosite, d'anomalies cutanées caractéristiques à type d'hyperkératose érythémateuse palmaire fissuraire des mains et de syndrome de Raynaud ainsi qu'une polyarthrite inflammatoire. L'atteinte pulmonaire y est fréquente et peut être révélé par une pneumopathie infiltrante diffuse (PID). Sur le plan biologique, cette affection se caractérise par la présence d'auto-anticorps antinucléaires spécifiques appelés « antisynthétases » (AAS) ciblant les enzymes intervenant dans la transcription de l'ARN-t d'où le nom du syndrome. Parmi les AAS, l'anticorps anti-Jo-1 a été le premier découvert et le seul utilisé en routine. Nous décrivons à travers ce manuscrit l'observation de 02 patients admis pour exploration d'une pneumopathie infiltrante diffuse, et dont le bilan étiologique était en faveur d'un syndrome des antisynthétases anti Jo-1 positif. Nous discuterons par la suite les principaux aspects cliniques, radiologiques et pronostic de cette affection.
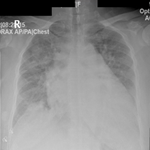
Observation 1: il s'agit d'un patient de 37 ans, sans antécédents pathologiques notables, qui consulte pour une dyspnée lentement progressive sur une durée d'un an aggravée récemment devenue stade III de la NYHA. Cela s'associait à une polyarthralgie inflammatoire des petites articulations, de topographie bilatérale et symétrique, une hyperkératose érythémateuse palmaire bilatérale ainsi qu'une fièvre prolongée. L'examen clinique a objectivé des râles crépitants basithoraciques. L'examen de la marche de 6 minutes a dévoilé une désaturation de 95 à 85%. La spirométrie a mis en évidence un trouble ventilatoire restrictif. Devant ce tableau, une tomodensitométrie thoracique a été pratiquée et a révélé un syndrome interstitiel fait de plage de verre dépoli à prédominance lobaire inférieure, des réticulations intra lobulaire, des images kystiques jointives à paroi épaisses réalisant un aspect de rayon de miel ainsi que des bronchioléctasies par traction (Figure 1). Dans le cadre du bilan étiologique, le bilan biologique a permis d'écarter une vascularite en mettant en évidence des ANCA (anticorps anti cytoplasme des neutrophiles) négatifs, AAN (anticorps anti nucléaires) et Ac anti jo-1 positifs qui ont été demandés devant la forte présomption diagnostic d'un SAS. Les CPK étaient normales par ailleurs. Le diagnostic d'une pneumopathie infiltrative diffuse sur syndrome des antisynthétases a été retenu. L'électromyogramme n'avait pas noté d'atteinte musculaire. Le patient fut mis sous corticothérapie associée au cyclophosphamide avec amélioration partielle de sa dyspnée.
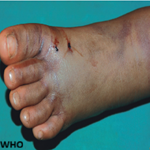
Observation 2: patiente de 73 ans, diabétique type 2 sous antidiabétiques oraux, hypertendue, opérée pour carcinome vésiculaire de la thyroïde, qui consulte pour une dyspnée lentement évolutive (stade III de la NYHA), associée à une polyarthralgie de type inflammatoire. L'examen clinique objective des râles crépitants basithoraciques, ainsi qu'une hyperkératose érythémateuse fissuraire palmaire bilatérale réalisant un aspect de main de mécanicien. L'examen des masses musculaires a objectivé une discrète douleur exquise à la palpation. Devant ce tableau clinique, une tomodensitométrie thoracique a été réalisée objectivant un syndrome interstitiel fait de micronodules et nodules pulmonaire à distribution centrolobulaire et sous pleuraux, des foyers de verre dépoli bilatéraux au niveau des bases pulmonaires, un épaississement des septas interlobulaires, ainsi qu'un petit foyer de condensation lobaire inférieur gauche. Les lésions étaient à prédominance postéro basales (Figure 2). Le bilan biologique avait objectivé un syndrome inflammatoire biologique, AAN+, ANCA-, Anti-Jo-1 positif. Les CPK étaient élevées. L'électromyogramme montrait un tracé myogène. Le diagnostic d'une pneumopathie infiltrante diffuse sur syndrome des antisynthététases a été retenu. La patiente fut mise sous corticothérapie et cyclophosphamide avec amélioration partielle de sa dyspnée (stade II de la NYHA).
Les myopathies inflammatoires idiopathiques, définies en 1975 par Peter et Bohan [1] sont caractérisées par: une faiblesse musculaire proximale progressive, une augmentation des valeurs de la créatine kinase sérique, des anomalies caractéristiques à l'électromyographie et un infiltrat inflammatoire des muscles squelettiques à la biopsie. L'étude des autos anticorps associés à cette entité pathologique a permis de définir et classer différentes entités cliniques. Ainsi, le SAS a été décrit pour la première fois en 1990 par Margerie et al. comme une myosite inflammatoire primitive fréquemment associée à une PID et caractérisée par la présence d'auto-anticorps dirigée contre l'une des ARNt synthétases [2]. Le plus fréquents d'entre eux est l'anticorps anti-Jo1. Successivement, sept autres auto-anticorps ont été découverts (anti-PL12, anti-PL7, anti- OJ, anti-EJ, anti-KS, anti- Zo, anti-YRS). Cependant leur présence mutuelle est exceptionnelle. Le syndrome des antisynthétases constitue 30 à 35 % des myosites inflammatoires, son incidence reste rare rejoignant celle des myopathies inflammatoires évaluée actuellement à 11/100.000 habitants [3]. Il touche plus la femme que l'homme (sex ratio F/H:3:2), sans prédominance d'âge. L'atteinte pulmonaire au cours du SAS est retrouvée dans 67 à 100% [4]. Sa physiopathologie reste encore obscure mais il semble que le poumon est l'organe où l'ARNt-synthétase devient anormalement immunogène. Cette atteinte s'associe plus fréquemment aux SAS à anti PL7, anti PL-12 et anti KS positifs [5]. En dehors des infections broncho-pulmonaires favorisées par l'atteinte de la musculature oropharyngée, les atteintes pulmonaires du SAS comprennent les atteintes parenchymateuses et les atteintes vasculaires. La PID a une prévalence de 77% [6]. Elle peut précéder le diagnostic du SAS (18%), être concomitante (64%), ou plus rarement apparaitre à posteriori [5]. Les symptômes respiratoires sont non spécifiques faits de toux et dyspnée. La fièvre peut s'y associer dans 26 % des cas [5]. Elle se présente sous 3 formes : PID aigüe, PID subaigüe /chronique et une PID asymptomatique de découverte fortuite sur un scanner thoracique systématique. Le scanner thoracique haute résolution reste l'examen clé pour l'exploration d'une PID associée à un SAS. L'acquisition spiralée est réalisée en fin d'inspiration profonde, patient en décubitus dorsal, avec des coupes natives fines (1-2 mm). La lecture se fait en double fenêtrage parenchymateux et médiastinal. L'usage des reconstructions multiplanaires (MPR) permet de déterminer le gradient apico basal et le mode maximum intensity projection (MIP) pour mieux détecter les micronodules. Les principales anomalies retrouvées par ordre de fréquence sont: l'atténuation en verre dépoli, les réticulations intra lobulaires, la condensation, le rayon de miel, les nodules et micro nodules pulmonaires, l'épaississement des septas interlobulaires et des lignes non septales, les bronchectasies par traction [7]. Ces anomalies prédominent en péri broncho vasculaire et postéro basale. Ces anomalies ont été présente chez nos 2 patients avec comme pattern dominant le verre dépoli et les réticulations intra loculaires. Les principales entités radiologiques sont par ordre décroissant: la pneumopathie interstitielle non spécifique (PINS), la pneumopathie interstitielle commune (PIC) et pneumopathie organisée cryptogénique (POC) [5, 7]. Il existe une bonne corrélation radio histologique, et de ce fait, la biopsie pulmonaire n'est plus obligatoire, de plus qu'elle n'est pas dénué de risque de complications [7]. L'aspect histologique le plus retrouvé est celui de PINS, mais aussi de POC et PIC [8]. L'atteinte aigüe, correspondant au dommage alvéolaire aigüe, peut mimer une pneumonie infectieuse avec cependant un bilan infectieux négatif et une mauvaise évolution sous antibiothérapie. Cette dernière est peu retrouvée vu que les patients les plus graves sont les moins biopsiés [8]. Les explorations fonctionnelles respiratoires (EFR) montrent classiquement un trouble ventillatoire restrictif avec une diminution de la diffusion locale du monoxyde de carbone (DLCO). Elles permettent certes l'orientation du diagnostic mais aussi l'évaluation de la gravité et le suivi des patients. Le syndrome restrictif peut être majoré par l'atteinte de la musculature respiratoire due à la myosite. Les résultats du lavage bronchiolo alvéolaire (LBA) sont très aspécifiques, montrant une alvéolite à CD8 ou une alvéolite neutrophilique associée à une éosinophilie [9]. Elle permet néanmoins d'écarter les diagnostiques différentiels notamment une mycobacteriose, une virose ou une pneumopathie d'hypersensibilité. L'hypertension artérielle pulmonaire (HTAP) est une complication vasculaire rare mais sévère au décours du SAS. Sa prévalence constitue 7,9% [10], avec un délai moyen de survenue de 7 ans par rapport au diagnostic du SAS selon une étude multicentrique menée par Hervier et al. portant sur 203 cas [10]. Cette prévalence rejoint celle de la survenue d'HTAP au cours des autres connectivites notamment le lupus et la sclérodermie [11]. A la différence des autres HTAP, celle du SAS est toujours associée à une PID et ne peut pas être isolée [10]. Le mécanisme de sa survenue se rapproche de celui des HTAP sur pathologie pulmonaire chronique entrainant une vasoconstriction hypoxique avec remodelage vasculaire secondaire. Cependant, plusieurs études ont démontré la discordance entre la sévérité de la PID et le développement d'une HTAP, et l'aggravation de l'HTAP malgré la stabilité de l'atteinte parenchymateuse pulmonaire [12]. Les signes cliniques évoquant une HTAP dans le carde du SAS sont une dyspnée disproportionnée par rapport à l'atteinte parenchymateuse pulmonaire et des signes d'insuffisance cardiaque droite. Comme pour toutes les connectivites, il serait recommandé de réaliser un dépistage systématique par échocardiographie. Le diagnostic de certitude n'est confirmé que par le cathétérisme cardiaque droite permettant d'éliminer une HTAP post capillaire et de confirmer son origine pré capillaire (Pression artérielle pulmonaire moyenne > 25 mm Hg, pression capillaire pulmonaire >15 mm Hg, débit cardiaque bas ou conservé) [13].
L'atteinte extra thoracique au décours du SAS est très hétérogène, elle comporte.
Une atteinte musculaire: l'atteinte musculaire a permis de classer le SAS parmi les myopathies inflammatoires. Sa prévalence est de 74% à 100% et peut être dans certains cas inférieure à celle de la PID. Elle s'observe plus dans les SAS à Ac anti-Jo-1 positif (70%) [6]. L'aspect clinique est variable, elle peut être sévère (déficit musculaire proximal), pauci symptomatique (fatigabilité à l'effort, myalgies), asymptomatique, ou absente (amyopathique). Une douleur à la palpation des masses musculaires devrait être recherchée à l'examen clinique. Le dosage de la créatine phospho kinase (CPK) doit être largement prescrit. Il est souvent positif sauf pour les formes amyopathiques volontiers associées aux formes anti -PL 7 et anti- PL 12. L'électromyogramme (EMG) montre un tracé myogène. L'IRM permet de guider un éventuel prélèvement biopsique. Ces 02 derniers restent inutiles devant l'association d'une PID, de signes extra thoraciques et la positivité de l'un des anticorps antisynthétases.
Atteinte articulaire: l'atteinte articulaire varie entre 16 et 94% [9]. Les polyarthralgies inflammatoires sont les plus fréquentes et les moins graves, prédominant sur les petites articulations. L'arthrite érosive est beaucoup moins fréquente et plus grave. Les calcifications péri articulaires et les arthrites non déformantes ont été également décrites. La positivité du facteur rhumatoïde ou des anticorps anti peptides citrulinés définit une entité mixte de chevauchement avec la polyarthrite rhumatoïde [14].
Atteinte cutanée:mains de mécanicien: il s'agit d'une hyperkératose fissuraire et érythémateuse de la face latérale des doigts. Sa prévalence est de l'ordre de 16 à 21 %. Bien que rare et aspécifique, elle permet d'orienter le diagnostic [15].
Phénomène de Raynaud: sa prévalence est de l'ordre de 50%; de sévérité variable, pouvant être responsable dans les cas extrêmes d'ulcère digitaux [16].
Autres manifestations cutanées peuvent être présentes notamment les papules de Gottron, l'érythème lilacé des paupières, sclérodactylie ou télangiectasie.
Autres atteintes plus rares: a) cardiaques: la péricardite reste la plus fréquente et est associée à l'anticorps anti PL7.
b) Digestives: l'atteinte œsophagienne est la plus prédominante, suivie de l'atteinte oropharyngée, causales de fausses routes, dysphagie et de reflux gastro œsophagien rebelle au traitement [7]. Par ailleurs, une altération de l'état général et amaigrissement ont été rapportés. La fièvre peut être présente dans 87 % notamment dans les formes actives et PID aigüe [9]. La découverte d'une PID ou d'une fibrose pulmonaire incite à rechercher des signes clinico biologiques de connectivites et pratiquer un dosage des anticorps anti nucléaires, facteur rhumatoïde et anticorps anti peptides citrulinés. Ainsi, devant la positivité de l'anticorps anti nucléaire, on procédera au dosage des anticorps anti synthétases devant un tableau fort évocateur du SAS. Néanmoins, il faudrait savoir demander la recherche spécifique d'anticorps anti-ARN-t synthétases devant un tableau clinique compatible associant myalgies, hyperkératose palmaire, phénomène de Raynaud et/ou augmentation inexpliquée des CPK, même en l'absence d'anticorps antinucléaires. La méthode de référence est l'immunofluorescence indirecte sur cellules Hep2. La fluorescence est cytoplasmique car les anticorps anti ARN-t synthétases font partie des anticorps anti antigènes nucléaires solubles et seront dirigés contre les protéines du cytosol. L'anticorps anti-JO-1 est systématiquement recherché et est positif chez 2/3 des patients. Par ailleurs la recherche des autres anticorps anti ARN-t synthétases doit être spécifiquement demandé car elle requiert des techniques plus spéciales [17]. L'atteinte pulmonaire interstitielle au cours du SAS est un élément de mauvais pronostic. Trois évolutions sous traitement ont été décrites: régression (20%), stabilité (80%), aggravation (20%) [18]. En effet, l'hétérogénéité des PID et les traitements immunosuppresseurs utilisés rendent le pronostic à long terme difficilement prévisible [17].
Néanmoins, quelques facteurs pronostiques ont pu être établis.
Le mode de révélation: la PID aigüe associant souvent dyspnée et fièvre est associée à un taux de mortalité élevé notamment si la dyspnée est sévère (stade III ou IV de la NYHA) [9]. L'atteinte des muscles respiratoires et la pneumopathie d'inhalation surajoutée semblent aggraver le pronostic.
Le type histologique: le dommage alvéolaire aigü est de pronostic sombre. La POC semble être de meilleur pronostic comparativement aux autres formes de PID notamment la PINS et la PIC [19].
L'atteinte vasculaire: à type d'HTAP est un facteur de mauvais pronostic. Cela justifie un suivi régulier et prolongé des patients atteint de SAS. Les éléments à surveiller comprennent les paramètres cliniques (évaluation de la faiblesse musculaire, dyspnée, crépitants, signes cutanés), les investigations musculaires (enzymes+/- EMG), l'imagerie thoracique et EFR ainsi que le dépistage d'une HTAP par échocardiographie. Le taux d'AAS peut devenir indosable en cas de guérison [20]. La prise en charge du SAS doit être globale et axée l'atteinte pulmonaire. La corticothérapie systémique (prédnisone à dose de 1mk/kg/j) associée aux mesures adjuvantes (calcium, vitaminothérapie D, potassium, régime hyposodé, bisphosphonates) reste le traitement de référence [21]. Parfois inefficace seule, elle nécessite par ailleurs l'adjonction d'un immunosuppresseur dans plus d'1/3 des cas [22]. Les immunosupresseurs les plus utilisés sont le cyclophosphamide, l'azathioprine, le tarcolimus et le mycophénolates mofétil [22]. Une médication prophylactique à base de triméthoprime sulfametoxazol (400/80mg/j) est recommandée en cas d'association corticoïde et immunosuppresseur. La thérapie ciblée à base de rituximab (anti CD20) semble être prometteuse pour les cas réfractaires [23]. La perfusion d'immunoglobuline est indiquée en cas de trouble de déglutition ou de pneumopathie d'inhalation [24]. Les plasmaphérèses peuvent être indiquées dans les cas sévères mais avec une efficacité modérée [25]. La réhabilitation respiratoire et la prévention des infections pulmonaires par la vaccination anti grippale et anti pneumococcique sont toujours de mise. Il n'existe par ailleurs aucun traitement spécifique de l'HTAP au cours du SAS. Sa mise en route n'est pas recommandée du fait du risque d'aggravation du rapport ventilation perfusion et d'altération des échanges gazeux. Malgré toutes ces mesures thérapeutiques, la PID reste la principale cause de mortalité au cours du SAS. Elle la majore de 40% selon les études [26].
Pour conclure, l'atteinte interstitielle pulmonaire reste très fréquente au cours du SAS. La présence de signes extra thoraciques caractéristiques et la positivité des anticorps anti ARN-t synthétases confirment le diagnostic. L'association corticoïdes et immunosuppresseurs se voit justifiée par la sévérité du pronostic et la mauvaise réponse à la corticothérapie seule chez ces patients. En plus des examens diagnostiques et de suivis classiques, les EFR apportent des éléments pertinents pour l'évaluation de l'efficacité thérapeutique. La recherche d'anticorps antisynthétases trouve actuellement son indication devant toute PID n'ayant pas fait preuve de son origine.
Les auteurs ne déclarent aucun conflit d'intérêts.
El Bouardi Nizar a réalisé une recherche bibliographique et a rédigé le manuscrit. Amina Alaoui a contribué à la rédaction de l'article. Meryem Boubou, Youssef Lamrani, Mustapha Maaroufi ont participé à la prise en charge diagnostique des patients. Baderdinne Alami a encadré, corrigé l'interprétation des images radiologiques et participé à la correction du manuscrit et à la sélection des images. Tous les auteurs ont participé à la conduite de ce travail. Ils ont lu et approuvé la version finale du manuscrit.
Figure 1: TDM thoracique
en coupe axiale, fenêtrage parenchymateux(PINS): syndrome interstitiel pulmonaire
fait de plage de verre dépoli, réticulations intra lobaires, d’images kystiques
jointive à paroi épaisse (flèche rouge) (rayon de miel) ainsi que des bronchioléctasies
par traction (flèche bleue) réalisant un aspect de PINS. Les anomalies prédominaient
en postéro basal en bilatéral
Figure 2: TDM thoracique en coupe axiale (a,b) et sagittale (c), fenêtrage parenchymateux: syndrome interstitiel fait de micronodules et nodules pulmonaires à distribution lymphatique centrolobulaires et sous pleuraux, des foyers de verre dépoli bilatéraux au niveau des bases pulmonaires, un épaississement des septas interlobulaires, Ces anomalies sont à prédominance postéro basale et en bilatéral
- Bohan A, Peter JB. Polymyositis and dermatomyositis. N Engl J Med. 1975; 292(7):344-7. Google Scholar
- Marguerie C, Bunn CC, Beynon HL et al. Polymyositis, pulmonary fibrosis and autoantibodies to aminoacyl-tRNA synthetase enzymes. Q J Med. 1990; 77 (282):1019-38. PubMed | Google Scholar
- Brouwer R, Hengstman GJD, Egberts WV et al. Autoantibody profiles in the sera of European patients with myositis. Ann Rheum Dis. 2001;60(2):116-23. PubMed | Google Scholar
- Allali D, Seebach JD. Syndrome des antisynthétases: diagnostic et traitements. Rev Med Suisse. 2015; 11(469): 808-12. Google Scholar
- Marie I, Josse S, Decaux O et al. Comparison of longterm outcome between anti-jo1- and anti-pl7/pl12 positive patients with antisynthetase syndrome. Autoimmun Rev. 2012; 11(10):739-45. Google Scholar
- Hervier B, Devilliers H, Stanciu R et al. Hierarchical cluster and survival analyses of antisynthetase syndrome: phenotype and outcome are correlated with anti-trna synthetase antibody specificity. Autoimmun Rev. 2012;12(2):210-7. PubMed | Google Scholar
- Marie I, Josse S, Hatron PYet al. Interstitial lung disease in anti-jo-1 patients with antisynthetase syndrome. Arthritis Care Res. 2013; 65(5):800-8. PubMed | Google Scholar
- Fujisawa T, Suda T, Nakamura Y et al. Differences in clinical features and prognosis of interstitial lung diseases between polymyositis and dermatomyositis. J Rheumatol. 2005; 32(1):58-64. PubMed | Google Scholar
- Tillie-Leblond I, Wislez M, Valeyre D et al. Interstitial lung disease and anti-jo-1 antibodies: difference between acute and gradual onset. Thorax. 2008; 63(1):53-9. PubMed | Google Scholar
- Hervier B, Meyer A, Dieval C et al. Pulmonary hypertension in antisynthetase syndrome: prevalence, aetiology and survival. Eur Respir J. 2013; 42(5):1271-82. PubMed | Google Scholar
- Pan TL, Thumboo J, Boey ML. Primary and secondary pulmonary hypertension in systemic lupus erythematosus. Lupus. 2000; 9(5):338-42. PubMed | Google Scholar
- Handa T, Nagai S, Kawabata D et al. Long-term clinical course of a patient with anti pl-12 antibody accompanied by interstitial pneumonia and severe pulmonary hypertension. Intern Med. 2005; 44(4):319-25. PubMed | Google Scholar
- Galie N, Hoeper MM, Humbert M et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Respir J. 2009; 34(6):1219-63. PubMed | Google Scholar
- Cavagna L, Fusetti C, Montecucco C et al. Anticyclic citrullinated peptide antibodies as markers of erosive arthritis in antisynthetase syndrome. J Rheumatol. 2010; 37(9): 1967. PubMed | Google Scholar
- Bachmeyer C, Tillie-Leblond I, Lacert A et al. "Mechanic's hands": a misleading cutaneous sign of the antisynthetase syndrome. Br J Dermatol. 2007; 156(1):192-4. PubMed | Google Scholar
- Hervier B, Lambert M, Hachulla E et al. Anti-synthetase syndrome positive for anti-isoleucyl-trna synthetase antibodies: an unusual case overlapping with systemic sclerosis and sjogren's syndrome. Rheumatology. 2011;50(6):1175-6. PubMed | Google Scholar
- Hervier B, Benveniste O. Phénotypes cliniques et pronostic du syndrome des antisynthétases. Rev Med Interne. 2014; 35(7):453-60. Google Scholar
- Ingegnoli F, Lubatti C, Ingegnoli A et al. Interstitial lung disease outcomes by high-resolution computed tomography (hrct) in anti-jo1 antibody-positive polymyositis patients: a single centre study and review of the literature. Autoimmun Rev. 2012; 11(5):335-40. PubMed | Google Scholar
- Tazelaar Hd, Viggiano Rw, Pickersgill J, Colby T. Interstitial lung disease in polymyositis and dermatopolymyositis: clinical features and prognosis as correlated with histologie findings. Am Rev Respir Dis. 1990; 141(3): 727-33.
- Bergoin C, Bure M. Le syndrome des anti-synthétases. Rev Mal Respir. 2002;19 (3): 371-374.
- Choy EH, Isenberg DA. Treatment of dermatomyositis and polymyositis. Rheumatology. 2002; 41(1):7-13. Google Scholar
- Stanciu R, Guiguet M, Musset L et al. Antisynthetase syndrome with anti-jo1 antibodies in 48 patients: pulmonary involvement predicts disease-modifying antirheumatic drug use. J Rheumatol. 2012; 39(9):1835-9. PubMed | Google Scholar
- Sem M, Molberg O, Lund MB et al. Rituximab treatment of the anti-synthetase syndrome: a retrospective case series. Rheumatology. 2009; 48(8):968-71. PubMed | Google Scholar
- Marie I, Hatron PY, Cherin P et al. Functional outcome and prognostic factors in anti-jo1 patients with antisynthetase syndrome. Arthritis Res Ther. 2013; 15(5):R149. PubMed | Google Scholar
- Bozkirli DE, Kozanoglu I, Bozkirli E et al. Antisynthetase syndrome with refractory lung involvement and myositis successfully treated with double filtration plasmapheresis. J Clin Apher. 2013; 28(6):422-5. PubMed | Google Scholar
- Dugar M, Cox S, Limaye V et al. Clinical heterogeneity and prognostic features of south australian patients with antisynthetase autoantibodies. Intern Med J. 2011; 41(9):674-9. Google Scholar
Search
This article authors
On Pubmed
On Google Scholar
Citation [Download]
Navigate this article
Similar articles in
Key words
Tables and figures
 Figure 1: TDM thoracique en coupe axiale, fenêtrage parenchymateux(PINS) : syndrome interstitiel pulmonaire fait de plage de verre dépoli, réticulations intra lobaires, d´images kystiques jointive à paroi épaisse (flèche rouge) (rayon de miel) ainsi que des bronchioléctasies par traction (flèche bleue) réalisant un aspect de PINS. Les anomalies prédominaient en postéro basal en bilatéral
Figure 1: TDM thoracique en coupe axiale, fenêtrage parenchymateux(PINS) : syndrome interstitiel pulmonaire fait de plage de verre dépoli, réticulations intra lobaires, d´images kystiques jointive à paroi épaisse (flèche rouge) (rayon de miel) ainsi que des bronchioléctasies par traction (flèche bleue) réalisant un aspect de PINS. Les anomalies prédominaient en postéro basal en bilatéral
 Figure 2: TDM thoracique en coupe axiale (a,b) et sagittale (c), fenêtrage parenchymateux: syndrome interstitiel fait de micronodules et nodules pulmonaires à distribution lymphatique centrolobulaires et sous pleuraux, des foyers de verre dépoli bilatéraux au niveau des bases pulmonaires, un épaississement des septas interlobulaires, Ces anomalies sont à prédominance postéro basale et en bilatéral
Figure 2: TDM thoracique en coupe axiale (a,b) et sagittale (c), fenêtrage parenchymateux: syndrome interstitiel fait de micronodules et nodules pulmonaires à distribution lymphatique centrolobulaires et sous pleuraux, des foyers de verre dépoli bilatéraux au niveau des bases pulmonaires, un épaississement des septas interlobulaires, Ces anomalies sont à prédominance postéro basale et en bilatéral