Carcinome à cellule vitreuse du col de l’utérus: à propos d’un cas et revue de littérature
Ihssane Hakimi, Abdelghani Zazi, Hafsa Chahdi, Khalid Guelzim, Jaouad Kouach, Myabdellah Babahabib, Myehdi Elhassani, Driss Moussaoui Rahali, Mohammed Dehayni
Corresponding author: Ihssane Hakimi, Service de Gynécologie Obstétrique, Hôpital Militaire d’Instruction Mohammed V, Rabat, Maroc 
Received: 27 Jul 2015 - Accepted: 07 Sep 2015 - Published: 18 Sep 2015
Domain: Maternal and child health
Keywords: Carcinome à cellule vitreuse du col utérin, Meta analyse, col de l´utérus
©Ihssane Hakimi et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Ihssane Hakimi et al. Carcinome à cellule vitreuse du col de l’utérus: à propos d’un cas et revue de littérature. Pan African Medical Journal. 2015;22:55. [doi: 10.11604/pamj.2015.22.55.7607]
Available online at: https://www.panafrican-med-journal.com//content/article/22/55/full
Original article 
Carcinome à cellule vitreuse du col de l’utérus: à propos d’un cas et revue de littérature
Carcinome à cellule vitreuse du col de l’utérus: à propos d’un cas et revue de littérature
Ihssane Hakimi1 &,, Abdelghani Zazi1, Hafsa Chahdi2, Khalid Guelzim1, ,Jaouad Kouach1, Myabdellah Babahabib1, Myehdi Elhassani1, Driss Moussaoui Rahali1, Mohammed Dehayni1
1Service de Gynécologie Obstétrique, Hôpital Militaire d’Instruction Mohammed V, Rabat, Maroc, 2Service d’Anatomie Pathologique, Hôpital Militaire d’Instruction Mohammed V Rabat, Maroc
&Auteur correspondant
Ihssane Hakimi, Service de Gynécologie Obstétrique, Hôpital Militaire d’Instruction Mohammed V, Rabat, Maroc
Le carcinome à cellule vitreuse du col de l'utérus est un type de histologique rare de cancer du col de l'utérus qui survient à un âge plus jeune, et s'associe au risque élevé d'échec thérapeutique et le pronostic est plus mauvais en comparaison au type cellulaire squameux. La radiothérapie est associée au risque diminué de récidive. Le but de cette étude est de récapituler à travers d'une observation et une revue de littérature les données sur l'incidence, le comportement clinique et la survie globale de patients avec le carcinome à cellule vitreuse du col de l'utérus.
Le cancer du col de l'utérus est le 14ème cancer fréquent dans USWOMEN dont 80% de cas arrivant des pays en voie de développement. Pour tous les cancers du col de l'utérus, indépendants de type de histologique, la survie en général de 5 ans s'approche de 75%. Des carcinomes cellulaires squameux représentent 90% avec la majorité de 10% restants étant des adénocarcinomes. Ces dernières années, l'incidence d'adénocarcinomes a augmenté [1,2]. Le carcinome à cellule vitreuse du col de l'utérus a été reconnu comme un sous-type de cancers du col de l'utérus adénosquameux mixtes. D'autres cancers du col de l'utérus adénosquameux mixtes incluent adénocarcinome mûr non différenciée. Des caractéristiques des cellules vitreuses sont aussi été identifiées comme de larges cellules non différencié non kératinisés des cancers du col de l'utérus [3]. Le carcinome à cellule vitreuse du col de l'utérus est connu historiquement de répondre mal à la radiation et la chirurgie avec les taux de survie les plus faibles [4]. Des directives actuelles pour le traitement de cancers du col de l'utérus, y compris à cellule vitreuses sont les même que de carcinome cellulaire squameux du col de l'utérus. En raison de la rareté de cette maladie et manque d'études prospective, la gestion du carcinome à cellule vitreuse du col de l'utérus n'a pas été spécifiquement définie. Des protocoles de traitement utilisés dans le passé ont des résultats pauvres. Le but de ce méta analyses est de rapporter l'incidence, des signes cliniques et la survie globale de cette variante de tumeur rare.
Mme A.A âgée de 41 ans, grande multipare, sans antécédents pathologiques notables, admise dans un tableau de métrorragie poste coïtale, à l'examen on trouve un col ulcéré de 4 cm (Figure 1) avec atteinte des paramètres proximaux des deux cotés, cul de sac vaginaux intacts et cloison recto vaginale libre. Une IRM pelvienne confirme l'examen clinique avec un stade IIB proximal. La patiente a bénéficié d'une biopsie qui revient en faveur d'une tumeur à cellule vitreuse (Figure 2) pour laquelle elle a reçu 25 séances de radiothérapies et la curiethérapie et six cures de chimiothérapie à base de cisplatin. Une IRM de contrôle qui montre une régression totale du processus tumorale avec absence d'anomalie de signale intra utérin et sans adénopathies profondes ni épanchement. La patiente a ensuite subi une colpo hystérectomie élargie avec lymphadénectomie. La surveillance à un an par des examens cliniques et de frottis de contrôle ne montre pas de signe de récidives.
Glucksmannn et al est le premier à décrire des carcinomes à cellules vitreuses en 1956 comme ayant trois caractéristiques distinctes: 1. cytoplasme d'apparence de verre dépoli, 2. Parois cellulaires distinctes et 3. Grands noyaux avec nucléole proéminent [3,4]. La classification pathologique de cette tumeur est stvariable et histologiquement présente des variabilités dans des résultats rapportés. Nunez et al, Pak a exposé le carcinome à cellule vitreuse du col de l'utérus comme de grande cellule, non-kératinisées [5-7]. Tamimi et al a discuté la possibilité de d'étendre la classification de cellule vitreuse comme étant une caractéristique trouvée dans des carcinomes non différenciés et des grands cancers cellulaires non-kératinisées [8]. Costa et al. différencie le carcinome à cellule vitreuse du col de l'utérus des cancers adenésquameus avec la prédominance des caractéristiques des cellulaires vitreuses (N85%). En général, il semble y avoir un spectre de caractérisation pathologique pour le carcinome à cellule vitreuse du col de l'utérus qui devrait être considéré comme une forme mal différenciée de carcinome adénosquameux mixte. Il est probable que la mesure de participation cellulaire vitreuse dicte la réponse au traitement incluant la radiothérapie. Dans cette meta-analyse, les patients avec le carcinome à cellule vitreuse du col de l'utérus sont plus jeunes (l'âge moyen 45) en comparaison de tous les cancers du col de l'utérus dans notre observation l'âge de notre patiente est 41 ans. La majorité de patients était blanche (64.9 %) et il n'y avait aucun impact significatif sur la survie globale. Les patients diagnostiqués étaient principalement noir, alors que dans notre observation la patiente est blanche. La présentation clinique du carcinome à cellule vitreuse du col de l'utérus est semblable au cancer du col de l'utérus envahissant avec le saignement vaginal qui semble être le symptôme prédominant. Le comportement clinique incluant la réponse au traitement de ces carcinomes est difficile de caractériser avec des informations limitées rapportés par la série. La distribution d'étape semble être semblable à celui de carcinome cervical squameux et la majorité des patients (79 %) a été diagnostiquée au stade I ou II (36) dans notre observation la patiente était de stade IIBa. La survie globale a été résolument diminuée et La survie médiane pour stade II était 25 mois et a diminué à 3 mois pour le stade IV de la maladie. Tandis que le résultat global du carcinome à cellule vitreuse du col de l'utérus est pauvre, la maladie de stade précoce, particulièrement quand elle est localisée au col de l'utérus, peut avoir des taux de guerrison comparables à celui de tous cancers du col de l'utérus.
Gris et al. a rapporté une survie globale de 86 % pour stade I, le taux de survie global était 22% [9]. En raison du manque de preuve des recommandations de traitement, les patients avec carcinome à cellule vitreuse du col de l'utérus ont reçu des traitements divers incluant la chirurgie, la radiation ou la chimiothérapie aux combinaisons diverses [10-13]. La radiosensibilité est soulignée dans l'étude par Randall et al. la majorité des stades traitées par chirurgie (44.1%) ou chirurgie suivie par radiothérapie (32.2%). À 11.5% des patients, tous les trois modalités thérapeutiques incluent la chirurgie, la radiothérapie et chimiothérapie sont utilisées. La majorité des stades II et III des patientes sont traitées par radiothérapie seulement (46.9% et 53.8%, respectivement). Le taux de récidives par ce traitement était le plus haut parmi des patients traités seulement avec la chirurgie (32.7%), en comparaison des patients a traité avec la chirurgie suivie par la radiothérapie (11%). L'utilisation de chimiothérapie pour optimisation des résultats à la radiothérapie dans le cancer du col de l'utérus est soutenue par sept grandes études randomisées qui ont démontré une réduction marquée du taux de récidives et l'amélioration significative de la survie quand la chimiothérapie a été utilisée simultanément avec la radiothérapie, utilisant la chimiothérapie par cisplatin [14,15]. Les patients avec le carcinome cellulaire squameux, adénocarcinome et des variantes histologiques rares ont été inclus dans ces études. De façon intéressante, dans le stade II de la maladie la combinaison de radiation et la chimiothérapie semble améliorer le résultat de survie. Le taux de récidives tardives était 33 % pour des patients a traité avec la chirurgie, 3 % pour des patients ont traité avec la radiation et 0 % pour des patients ont traité avec radio-chimiothérapie [16,17]. Dans l'étude par Duenas et al. la chimiothérapie adjuvante avec cisplatin et gemcitabine a diminué les récidives et a amélioré en général la progression la survie globale des malades avec stade II-IV le cancer du col de l'utérus aux dépens de la toxicité accrue mais cliniquement gérable [16]. Des patients qui ont été inscrits dans cette étude, 6% ont été diagnostiqués avec les types divers d'adenocarcinoma incluant le carcinome à cellule vitreuse du col de l'utérus. Littman.et al a rapporté que la résistance au traitement peut être due au développement rapide de la tumeur, et la fréquence des métastases éloignées et la diminution de la radiosensibilité [18]. Tsukahara et al a attribué bas radiosensibilité à une augmentation relative de cellules de tumeur anoxiques, des parois cellulaires épaisses et l'attache forte par des fibres de collagène observées dans l'etude histologic des carcinomes à cellule vitreuse du col de l'utérus des échantillons [19]. Depuis la publication par Littman et les groupes de Tskukahara, plusieurs études se sont concentrées sur radiosensibilité d'adénocarcinomes et des cancers du col de l'utérus adénosquameux. Les études ont montré que les adénocarcinomes et des cancers adénosquameux ont plus de radiorésistances comparées avec les cancers cellulaires squameux du col de l'utérus [20]. La différence dans la survie entre les types d'histologiques de cancers du col de l'utérus ne montrant aucune différence significative dans la survie par le type d'histologique. La plus grande étude avec n = 11,157 par Shingletonet et al n'a pas trouvé de différences significatives de la survie de 5 ans entre le carcinome cellulaire squameux, adénocarcinome, ou le carcinome adénosquameux à part le stade II des patients [20]. HPV à haut risque a été détecté dans la majorité d'échantillons de carcinome à cellule vitreuse du col de l'utérus GCCC analysés; sans aucune conclusion sur l'association ou la signification pronostique. Les découvertes sur l''strogène et l'expression de récepteur de progestérone ont été variables [19,20].
Pour conclure, le carcinome à cellule vitreuse du col de l'utérus est une variante de tumeur rare avec la présentation de patients à un âge generalement plus jeune que la population générale avec le cancer du col de l'utérus. La distribution de stades est semblable à celui de carcinome cellulaire squameux du col de l'utérus. Survie de Cinq année est inférieure en comparaison de tous les cancers du col de l'utérus pour le stade II et IV. Alors que pour le stade III, le taux de survie globale est comparable. La survie En général de 5 ans pour toutes les stades est beaucoup plus basse comparé à tous les cancers du col de l'utérus (54.8% contre 75%). La radiothérapie comme le traitement adjuvant principal ou postopératoire est associée au contrôle local amélioré. La chimiothérapie devenant sensible pourrait améliorer les résultats. Étant donné le risque élevé de récidives, on devrait donner la considération à la chimiothérapie adjuvante.
Les auteurs ne déclarent aucun conflit d’intérêts.
Tous les auteurs ont contribué à la rédaction de ce travail. Tous ont lu et approuvé la version finale du manuscrit.
Figure 1: le processus
tumoral cervical
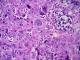
Figure 2: coloration émétine eodine de grossissement x40 montrant une prolifération tumorale faites de nappe de cellules atypiques
- Alfsen GC, Thoresen SO, Kristensen GB, Skovlund E, Abeler VM. Histopathologic subtyping of cervical adenocarcinoma reveals increasing incidence rates of endometrioid tumors in all age groups: a population based study with review of all nonsquamous cervical carcinomas in Norway from 1966 to 1970, 1976 to 1980, and 1986 to 1990. Cancer. 2000 Sep 15;89(6):1291-9. PubMed | Google Scholar
- Ries LAG, Harkins D, Krapcho M, Mariotto A, Miller BA, Feuer EJ et al, editors. SEER Cancer Statistics Review. Bethesda, MD: National Cancer Institute. 1975-2003; 13(6):123-54. PubMed | Google Scholar
- Maier RC, Norris HJ. Glassy cell carcinoma of the cervix. Obstet Gynecol. 1976; 60(2):219-24. PubMed | Google Scholar
- Glucksmann A, Cherry C. Incidence, histology, and response to radiation of mixed carcinomas (adenoacanthomas) of the uterine cervix. Cancer. 1956;9(5):971-9. PubMed | Google Scholar
- Mikami M, Ezawa S, Sakaiya N, Komuro Y, Tei C, Fukuchi T et al. Response of glassy cell carcinoma of the cervix to cisplatin, epirubicin, and mitomycin C. Lancet. April 1 2000;355(9210):1159-60. PubMed | Google Scholar
- Morris M, Eifel PJ, Lu J, Grisby P, Levenback C, Stevens R, et al. Pelvic radiation with concurrent chemo- therapy compared with pelvic and para-aortic radiation for high-risk cervical cancer. N Engl J Med. 1999;340(15):1137-43. PubMed | Google Scholar
- Pak HY, Yokota SB, Paladugu RR. Glassy cell carcinoma of the cervix: Cytologic and clinicopathologic analysis. Cancer. 1983;52(2):307-12. PubMed | Google Scholar
- Tamimi HK, Ek M, Hesla J, Cain JM, Figge DC, Greer BE. Glassy cell carcinoma of the cervix redefined. Obstet Gynecol. Jun 1988;71(6 Pt 1):837-41. PubMed | Google Scholar
- Gray HJ, Garcia R, Tamimi HK, KohWJ, Goff BA, Greer BE et al. Glassy cell carcinoma of the cervix revisited. Gynecol Oncol. 2002;85(2):274-7. PubMed | Google Scholar
- Ferrandina G, Salutari V, Petrillo M, Carbone A, Scambia G. Conservatively treated glassy cell carcinoma of the cervix. World J Surg Oncol. 2008;6(4):92. PubMed | Google Scholar
- Fu YS, Reagan JW, Hsiu JG, Storaasli JP, Wentz WB. Adenocarcinoma and mixed carcinoma of the uterine cervix: IA clinicopathologic study. Cancer. 1982;49(12):2560-70. PubMed | Google Scholar
- Nasu K, Takai N, Narahara H. Multimodal treatment of glassy cell carcinoma of the uterine cervix. J Obstet Gynaecol Res. June 2009;35(3):584-7. PubMed | Google Scholar
- RandallME, ConstableWC, Hahn SS, Kim JA, Mills SE. Results of the radiotherapeutic management of carcinoma of the cervix with emphasis on the influence of histologic classification. Cancer. 1988;62(1):48-53. PubMed | Google Scholar
- Lai CH, Hsueh S, Hong JH, Chang TC, Tseng CJ, Chou HH et al. Are adenocarcinomas and adenosquamous carcinomas different from squamous carcinomas in Stage IB and II cervical cancer patients undergoing primary radical surgery? Int J Gynecol Cancer. 1999;9(9):28-36. PubMed | Google Scholar
- Piura B, Rabinovich A, Meirovitz M, Yanai-Inbar I. Glassy cell carcinoma of the uterine cervix. J Surg Oncol. 1999;72(4):206-10. PubMed | Google Scholar
- Duenas-Gonzalez A, Zarba JJ, Patel F, Alcedo JC, Beslija S, Casanova L, et al. Phase III, open-labes, randomized study comparing concurrent gemcitabine plus cisplatin and radiation followed be adjuvant gemcitabine and cisplatin versus concurrent cisplatin and radiation in patients with stage IIB to IVA carcinoma of the cervix. JCO. May 1 2011;29(13):1678-85 2011, Mar 28.. PubMed | Google Scholar
- Nagai T, Okubo T, Sakaguchi R, Seki H, Takeda S. Glassy cell carcinoma of the uterine cervix responsive to neoadjuvant intraarterial chemotherapy. Int J Clin Oncol. 2008;13(6):541-4. PubMed | Google Scholar
- Littman P, Clement PB, Henriksen B, Wang CC, Robboy SJ, Taft PD et al. Glassy cell carcinoma of the cervix. Cancer. 1976;37(5):2238-46. PubMed | Google Scholar
- Tsukahara Y, Sakai Y, Ishii J, Iwai S, Fukuta T. A clinicopathological study on glassy cell carcinoma of the cervix. Acta Obstet Gynaecol. 1981;33(5):699-704. PubMed | Google Scholar
- Hirashima Y, Kobayashi H, Nishiguchi T, Miura K, Kanayama N. A case of glassy cell carcinoma of the uterine cervix effectively responding to chemotherapy with paclitaxel and carboplatin. Anticancer Drugs. 2001;12(7):627-30. PubMed | Google Scholar