Agénésie de la valve pulmonaire: à propos d’un cas chez une sénégalaise de 24 ans
Affangla Désiré Alain, Leye Mohamed, Dia Aliou Amadou, Ndiaye El Hadj Mohamed, Aw Fatou, Bazolo Georges Antoine, Kane Abdoul
Corresponding author: Affangla Désiré Alain Hôpital Saint Jean de Dieu/UFR sciences de la santé université de Thiès, BP 43 Thiès, Sénégal 
Received: 20 Aug 2013 - Accepted: 07 May 2014 - Published: 24 May 2014
Domain: Clinical medicine
Keywords: Agénésie, valve pulmonaire, cardiopathie congénital
©Affangla Désiré Alain et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Affangla Désiré Alain et al. Agénésie de la valve pulmonaire: à propos d’un cas chez une sénégalaise de 24 ans. Pan African Medical Journal. 2014;18:76. [doi: 10.11604/pamj.2014.18.76.3250]
Available online at: https://www.panafrican-med-journal.com//content/article/18/76/full
Agénésie de la valve pulmonaire: à propos d’un cas chez une sénégalaise de 24 ans
Affangla Désiré Alain1,2, Leye Mohamed2,3, Dia Aliou Amadou1,2, Ndiaye El Hadj Mohamed1,2, Aw Fatou1, Bazolo Georges Antoine4, Kane Abdoul2,5
1Hôpital Saint Jean de Dieu, Thiès, Senegal, 2UFR des sciences de la santé de l’université de Thiès. BP 43 Thiès, Senegal, 3Hôpital Barthimée, Thiès, Senegal, 4Pédiatre. Centre Hospitalier Régional de Louga, Sénégal, 5Hôpital Général Grand Yoff Dakar, Senegal
&Auteur correspondant
Dr. Affangla Désiré Alain Hôpital Saint Jean de Dieu/UFR sciences de la santé université de Thiès, BP 43 Thiès, Sénégal.
L’agénésie de la valve pulmonaire est une cardiopathie congénitale rare (6/3000 cardiopathies congénitales). La tolérance clinique et le pronostic de la forme avec communication inter ventriculaire dépendent de la compression des voies respiratoires par l’artère pulmonaire dilatée. Nous rapportons un cas chez une sénégalaise de 24 ans.
L’agénésie des valves pulmonaires est une cardiopathie congénitale rare (6/3000 cardiopathies congénitales) définie par une absence totale ou une hypoplasie sévère des sigmoïdes pulmonaires. Dans la majorité des cas, elle s’associe à d’autres anomalies, en particulier une communication inter ventriculaire isolée. La tolérance clinique et le pronostic dépendent particulièrement de la compression des voies respiratoires par l’artère pulmonaire dilatée.
A.N, sénégalaise de 24 ans, présentant une dyspnée d’effort et des lipothymies depuis l’âge d 12 ans. L’examen clinique retrouve un état de maigreur avec IMC à 15, une cyanose, un hippocratisme digital avec une SpO2 à 66% en air ambiant. A l’auscultation, un souffle systolique rude éjectionnel 4-5/ 6 frémissant associé à un souffle diastolique au foyer pulmonaire. Il n’y a pas de signes périphériques d’insuffisance cardiaque.
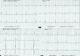
L’électrocardiogramme s’inscrit en rythme sinusal avec une déviation axiale droite à 120%, avec une hypertrophie auriculaire et ventriculaire droite de type systolique (Figure 1).
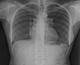
A la radiographie télécœur de face on note une cardiomégalie modérée avec un index cardio- thoracique à 0, 53, une convexité de l’arc moyen gauche, une vascularisation pauvre en périphérie et une artère pulmonaire proximale dilatée (Figure 2).
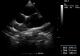
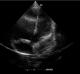
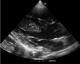
L’écho-doppler cardiaque (Figure 3, Figure 4) montre des cavités droites modérément dilatées, des cavités gauches de bonne taille avec une bonne fonction systolique des ventricules. Il existe une large communication inter ventriculaire (CIV) sous aortique avec shunt bidirectionnel à travers la CIV. On note une Dextroposition aortique avec continuité mitro -aortique. Il existe une agénésie de la valve pulmonaire avec accélération à 4m/s du flux pulmonaire antérograde. Le tronc et les branches de l’artère pulmonaires sont dilatés. La bifurcation pulmonaire est bien dégagée, les deux branches pulmonaires naissent du tronc de l’artère pulmonaire et il n’y a pas de sténose sur les deux branches pulmonaires. Le canal artériel est fermé. Il y avait une insuffisance pulmonaire modérée à moyenne.
L’angioscanner thoracique (Figure 5) montre sur une coupe axiale une dilatation importante du tronc de l’artère pulmonaire et de ses branches avec un discret effet de masse sur les bronches souches.
L’exploration fonctionnelle respiratoire(EFR) par spirométrie montre une restriction pulmonaire modérée avec une capacité vitale lente à 70 % de la valeur théorique.
L’agénésie des valves pulmonaires est une malformation cardiaque rare. Cette malformation associe une hypoplasie restrictive de l’anneau pulmonaire, une agénésie des valves pulmonaires et une dilatation anévrysmale des artères pulmonaires. Lorsque l’agénésie de la valve pulmonaire est associée à une communication inter ventriculaire (CIV), cette malformation est considérée par certains comme une variante de la tétralogie de Fallot dont elle représenterait 5% des formes [1, 2].
La tolérance clinique est le plus souvent mauvaise associant des signes respiratoires par compression bronchique secondaire aux artères pulmonaires anévrysmales à des signes d’insuffisance cardiaque dans l’agénésie pulmonaire sans communication inter ventriculaire [3]. Cette malformation peut être relativement bien tolérée et vue chez l’adulte dans la forme avec CIV, comme le cas que nous rapportons.
Chez notre patiente, la cyanose, l’hippocratisme digital et le souffle systolique de sténose pulmonaire font évoquer de tétralogie de Fallot plus fréquemment vue chez l’adulte [3]. Cependant l’absence de malaises anoxiques et de squatting nous ont fait douter de ce diagnostic.
A la radiographie télécœur, l’hypo vascularisation pulmonaire associée à la convexité de l’arc moyen gauche et la dilatation de la partie proximale de l’artère pulmonaire gauche (Figure 2) sont évocateurs du diagnostic de l’agénésie pulmonaire.
Le diagnostic est fermement établi par l’écho doppler cardiaque qui montre le micro développement des sigmoïdes pulmonaires, une dilatation importante de l’artère pulmonaire et de ses branches, un large infundibulum, une fuite pulmonaire importante, la CIV permettent d’établir le diagnostic.
La tolérance clinique et le pronostic dépendent principalement du développement du ventricule droit [4] et de la compression bronchique par l’artère pulmonaire dilatée [5]. Notre patiente est symptomatique depuis l’âge de 12 ans mais elle ne présente pas de signes majeurs de compression bronchique (bronchite répétitive et détresse respiratoire avec wheezing) [6] et le ventricule droit a un développement normal. L’angioscanner thoracique peut être d’un apport capital dans l’exploration des malformations cardiaques [5-8] et montre chez notre patiente une dilatation bilatérale des artères pulmonaires comprimant discrètement les bronches souches (Figure 5).
L’exploration fonctionnelle respiratoire (EFR) par spirométrie peut contribuer à apprécier le retentissement respiratoire [1,2] et montre chez notre patiente une restriction pulmonaire modérée avec une capacité vitale lente à 70 % de la valeur théorique.
Un traitement chirurgical, comprenant une ouverture de l’anneau, une plastie des branches [11-15] est envisagé chez notre patiente.
L’agénésie des valves pulmonaires avec communication inter ventriculaire est une cardiopathie congénitale à révélation le plus souvent tardive. L’échocardiographie-Doppler est l’examen de référence pour faire le diagnostic. Cependant l’angioscanner thoracique et la spirométrie contribuent qualitativement au diagnostic.
Les auteurs ne déclarent aucun conflit d’intérêts.
Chaque auteur a contribué dans la réalisation de cet article, en termes de: rédaction de l'article et initiation de l'étude: Désiré Alain Affangla, Mohamed Leye; prise en charge du patient : Désiré Alain Affangla, Mohamed Leye, Aliou Amadou Dia, El H Mohamed Ndiaye; recherche bibliographique et co-rédaction: Fatou Leye, Georges Antoine Bazolo; supervision du travail : Abdoul Kane. Tous les auteurs ont lu et approuvé la version finale du manuscrit.
Figure 1: ECG 12 dérivations s’inscrivant en rythme sinusal avec une déviation axiale droite à 120%, avec une hypertrophie auriculaire et ventriculaire droite
Figure 2: Radiographie
télécœur de face montrant une cardiomégalie modérée (index cardio- thoracique à 0,
53), une convexité de l’arc moyen gauche, une vascularisation pauvre en périphérie.
Dilatation de la partie proximale de l’artère pulmonaire gauche
Figure 3: Echographie
cardiaque, Incidence petit axe para sternale montrant l’agénésie de la valve
pulmonaire avec dilatation ectasique du tronc et des branches pulmonaires
Figure 4: échographie cardiaque en incidence 5 cavités apicale, montrant une large communication inter ventriculaire (CIV) sous une aorte dextroposée, une dilatation modérée du ventricule droit
Figure 5: Angioscanner thoracique en coupe axiale montrant une dilatation bilatérale des artères pulmonaires . Noter le discret effet de masse sur les bronches souches
- Haute Autorité de Santé, Protocole national de diagnostic et de soins. Juin 2008. Cardiopathies congénitales complexes : Tétralogie de Fallot. Enegal. Haute Autorité de Santé.
- Sauer Ursula. Agénésie des valves pulmonaires. Orphanet. 2003; 982. Accessible sur http://www.orpha.net/consor/cgi-bin/OC_Exp.php?Lng=FR&Expert=982. Acceder le 18 Aout 2013.
- Godart F, Rey C, Breviere G.M, Francart C, Vaksmann G. L'agénésie des valves pulmonaires. Expérience sur 20 ans. Archives des maladies du Cœur et des vaisseaux .1995 ; 88(5):673-679. PubMed | Google Scholar
- Pernot C, Worms AM, Henry M, Didier F, Louis JP. Pulmonary valve agenesia in infants. Arch Fr Pediatr. 1971 Nov; 28(9):953-70. PubMed | Google Scholar
- Watts JR Jr, Sonavane SK, Singh SP, Nath PH. Pictorial review of multidetector CT imaging of the preoperative evaluation of congenital heart disease. Curr Probl Diagn Radiol. 2013 Mar-Apr;42(2):40-56.. PubMed | Google Scholar
- Ghoshhajra BB, Sidhu MS, El-Sherief A, Rojas C, Yeh DD, Engel LC et al. Adult congenital heart disease imaging with second-generation dual-source computed tomography: initial experiences and findings. Congenit Heart Dis. 2012 Nov-Dec; 7(6):516-25. PubMed | Google Scholar
- Windram JD, Siu SC, Wald RM, Silversides CK. New directives in cardiac imaging: imaging the adult with congenital heart disease. Can J Cardiol. 2013 Jul; 29 (7):830-40.. PubMed | Google Scholar
- Bernardes RJ, Marchiori E, Bernardes PM, Monzo Gonzaga MB, Simões LC. A comparison of magnetic resonance angiography with conventional angiography in the diagnosis of tetralogy of Fallot. Cardiol Young. 2006 Jun; 16(3):281-8. PubMed | Google Scholar
- Mercer-Rosa L, Yang W, Kutty S, Rychik J, Fogel M, Goldmuntz E. Quantifying pulmonary regurgitation and right ventricular function in surgically repaired tetralogy of Fallot: a comparative analysis of echocardiography and magnetic resonance imaging. Circ Cardiovasc Imaging. 2012 Sep 1; 5(5): 637-43. PubMed | Google Scholar
- Howard S, Wan S, Freeman LJ. Congenital absence of the pulmonary valve. Heart. 2007 July; 93(7): 779. PubMed | Google Scholar
- Sakakibara T, Morikawa T, Goto K, Mizuba K, Imai Y. Congenital absence of the pulmonary valve associated with ventricular septal defect and pulmonary valve stenosis-successful surgery using a pulmonary heterograft and dacron patch graft. Nihon Kyobu Geka Gakkai Zasshi. 1973 Jul; 21(7):732-8. PubMed | Google Scholar
- Dubost C, Soyer R, Carpentier A, Deloche A, Lessana A. Pulmoanry valve agenesia: a study of 11 repair operations. Ann Chir Thorac Cardiovasc. 1975 Apr; 14 (2): 91-8. PubMed | Google Scholar
- Alsoufi B, Williams WG, Hua Z, Cai S, Karamlou T, Chan CC et al. Surgical outcomes in the treatment of patients with tetralogy of Fallot and absent pulmonary valve. Eur J Cardiothorac Surg. 2007 Mar; 31(3):354-9. PubMed | Google Scholar
- Brown JW, Ruzmetov M, Vijay P, Rodefeld MD, Turrentine MW. Surgical treatment of absent pulmonary valve syndrome associated with bronchial obstruction. Ann Thorac Surg. 2006; 82(6):2221-6. PubMed | Google Scholar
- Otero Coto E, Sogorb F, de la Sen ML, Muñoz C. Pulmonary valvular agenesis treated with cryopreserved pulmonary homograft. Rev Esp Cardiol. 1992 Nov; 45(9):595-7. PubMed | Google Scholar