Les tumeurs desmoides de la paroi thoracique : à propos de 12 cas
Marouane Lakranbi, Mohamed Smahi, Mehdi Maidi, Mohammed Bouchikh, Yassine Msougar, Yassine Ouadnouni, Hicham Fenan, Abdellah Achir, Mohammed Caidi, Ahmed Alaziz, Abdellatif Benosman
Corresponding author: Service de chirurgie thoracique au CHU de Fès, Maroc, Adresse: 250, Rue al ward hay essalam BP: 11000 Salè, Maroc, téléphone: 0021263660432 
Received: 04 Oct 2009 - Accepted: 08 Nov 2009 - Published: 10 Nov 2009
Domain: Clinical medicine
Keywords: Tumeur desmoide, Paroi thoracique, Chirurgie thoracique, Maroc
©Marouane Lakranbi et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Marouane Lakranbi et al. Les tumeurs desmoides de la paroi thoracique : à propos de 12 cas. Pan African Medical Journal. 2009;3:13. [doi: 10.11604/pamj.2009.3.13.134]
Available online at: https://www.panafrican-med-journal.com//content/article/3/13/full
Les tumeurs desmoides de la paroi thoracique : à propos de 12 cas
Marouane Lakranbi1,&, Mohamed Smahi1, Mehdi Maidi1, Mohammed Bouchikh1, Yassine Msougar1, Yassine Ouadnouni1, Hicham Fenan1, Abdellah Achir1, Mohammed Caidi1, Ahmed Alaziz1, Abdellatif Benosman1
1Service de chirurgie thoracique CHU Rabat, Maroc
&Auteur correspondant
Lakranbi Marouane, interne en chirurgie thoracique au CHU de Fès, Maroc, 250, Rue al ward hay essalam BP: 11000 Salè Maroc, telephone: 0021263660432
Les tumeurs desmoïdes sont des proliférations des tissus fibroblastiques, infiltrantes qui ne métastasent pas mais qui ont une très forte tendance à récidiver localement [1].
Ce travail a pour but d’évaluer, à travers l’expérience de notre service, les résultats du traitement chirurgical de ces tumeurs et de définir certains facteurs prédictifs de la récidive locale.
Il s’agit d’une étude rétrospective portant sur 12 cas de tumeurs desmoides de la paroi thoracique colligés dans le service de chirurgie thoracique au CHU de Rabat sur une période de 28 ans entre 1980 et 2008.
Il y avait 7 hommes et 5 femmes avec un age variant entre 17 et 52 ans. Deux patients avaient été opérés dans leurs antécédents pour un autre type de néoplasie thoracique : l’un, avait été opéré par thoracotomie postéro latérale pour un carcinome bronchique (lobectomie supérieure gauche) 13 ans auparavant et l’autre c’était une femme qui avait bénéficié d’une mastectomie droite pour carcinome mammaire six ans auparavant.
Sur le plan clinique, le maître symptôme était la douleur thoracique retrouvée dans 70% des cas alors que dans 30% des cas, les patients étaient venus consulter pour une masse non douloureuse de la paroi thoracique.
Aucun patient n’avait de syndrome de Gardner. Tous nos patients avaient bénéficié d’une radiographie thoracique et d’un scanner thoracique. Il y’ avait six localisations à gauche et six à droite.
Dans 10 cas, la tumeur était de siège latéral ; par ailleurs dans deux cas, le siége était antérieure.
Chez les deux patients ayant déjà été opérés pour un autre type de néoplasie, la tumeur était localisée en regard de l’ancienne cicatrice de l’incision chirurgicale.
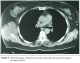
La taille tumorale variait entre 2 et 13 cm. L’envahissement de la paroi thoracique a été jugé superficiel, limité au plan sous cutané ou au plan musculaire superficiel dans 4 cas, alors que dans 8 cas l’envahissement était profond intéressant le plan musculaire profond et/ou le plan costal (figure 1) et dont un cas s’étendait même en intrathoracique.
La biopsie transpariètale scannoguidée a été faite dans 4 cas mais qui n’était pas concluante mettant en évidence un processus inflammatoire non spécifique. Chez deux patients, le diagnostic de tumeur desmoide a été obtenu en préopératoire par biopsie chirurgicale.
L’abord chirurgical a été électif à l’aplomb de la tumeur dans 11 cas alors qu’un cas avait nécessité une thoracotomie postero-latérale vu que la tumeur se développait surtout en endothoracique. La résection a été complète dans 11 cas et dans un cas, elle a été incomplète avec marges microscopiques positives.
Dans cinq cas, la tumeur adhérait fortement au plan costal et de ce fait une ouverture de la cavité pleurale a été nécessaire afin de réaliser une résection costale plus aisément avec une marge de résection de 5 cm. Aucune résection pulmonaire n’avait été faite. Dans un cas, la perte de substance a été importante nécessitant alors une greffe musculo-cutanée. Dans tous les cas, l’intervention s’était terminée par un drainage du lit tumoral éventuellement associé à un drainage pleural en cas de résection costale.
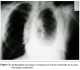
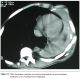
La durée d’hospitalisation variait entre 3 et 7 jours soit 4,1 jours en moyenne. Il n’y avait aucun cas de mortalité ni de complications post opératoires immédiates. La durée du suivi post opératoire variait entre 22 et 180 mois. 58% des patients avaient présenté une ou plusieurs récidives (entre une et cinq récidives). Ces récidives avaient été traité à chaque fois par une résection locale seule et dont un cas avait nécessité une greffe d’un lambeau musculo-cutané ; par ailleurs chez deux patients, on avait complété par une radiothérapie adjuvante (50 grays) : l’un avait une tumeur qui s’étendait surtout en intra thoracique avec atteinte du poumon et du médiastin rendant impossible la résection complète (figures 2 et 3) ; chez ce patient, la croissance tumorale est restée stable avec un recul de deux ans ; l’autre patient, c’était une femme qui avait bénéficié six ans auparavant d’une mastectomie et la radiothérapie adjuvante avait été réalisée chez elle après sa cinquième récidive ; cette patiente était décédée trois mois après par insuffisance cardiaque et rénale. L’ensemble des données sont résumées dans le tableau 1 .
Les tumeurs desmodies ont été décrites pour la première fois en 1832 par Mac Farlane [2] ; un siècle plus tard, Mankin soulignait la diversité des localisations. Différentes dénominations ont été attribué à ces tumeurs telles que, les fibromes desmoïdes des parties molles ou fibromes envahissants cependant certains auteurs préfèrent le terme de sarcome de bas grade de malignité [3] vu leur tendance à l’évolution locale ainsi qu’à leur haut risque de récidive même après résection complète.
Toutefois, ces tumeurs fibreuses restent rares, mais non exceptionnelles. En effet, elles représentent approximativement 0,03 % des tumeurs solides [2] et 3,6 % des tumeurs des parties molles avec une incidence de 2 à 4 nouveaux cas par 100000 habitants [4]. L’atteinte concerne sans prédominance raciale, l’adolescent et l’adulte jeune avec une prédilection pour la femme mais reste plus rare chez l’enfant [5]. Dans notre série la prédominance est plutôt masculine.
La localisation thoracique fait partie des tumeurs desmoïdes extra abdominales où elle représente le deuxième site le plus fréquent après l’atteinte des épaules et avant celles des cuisses et de la région cervicale [1] alors que l’atteinte endothoracique reste exceptionnelle [6]. A l’heure actuelle, aucune étiologie n’est certaine, mais trois hypothèses étiopathogéniques occupent le devant de la scène [7] : (1) l’hypothèse traumatique se fonde sur la fréquence relative des tumeurs desmoïdes sur les cicatrices opératoires ; Il s’agirait de la transformation fibreuse d’un hématome [8-9]. (Deux cas dans notre série) ; (2) l’hypothèse hormonale [8-11] part de la constatation d’une croissance rapide de la tumeur chez la femme enceinte et une croissance lente et même des régressions spontanées en période post ménopausique ; (3) l’hypothèse génétique [8-9,12] est basée d’une part sur l’association fréquente à la polypose colique familiale (syndrome de Gardner), d’autre part sur l’étude de l’arbre généalogique des patients.
La traduction clinique des tumeurs desmoïdes est pauvre. En dehors de la masse qui amène les malades à la consultation, il y a lieu de noter la douleur qui survient quand il y a compression des structures adjacentes en particulier nerveuses. Cette tumeur de découverte souvent fortuite est bosselée, ferme, indolore et n’adhère pratiquement jamais à la peau et se situe en plein corps musculaire [9,11]. Radiologiquement, c’est une masse des parties molles qui érode souvent le tissu osseux adjacent [13].
Le diagnostic histologique peut être apporté par biopsie chirurgicale permettant d’obtenir de gros fragments alors que la ponction biopsie transparietale est souvent non contributive. Sur le plan microscopique, la lésion est mal limitée avec infiltration des tissus adjacents notamment musculaires.la prolifération est faite de cellules fusiformes séparées les unes des autres par un abondant tissu collagène, sans atypies cellulaires.
Le diagnostic différentiel se pose essentiellement avec un fibrosarcome cependant ce dernier est plus uniformément cellulaire, avec un agencement plus fasciculaire montrant une atypie cellulaire et moins de contingent collagenique, c’est dire l’importance d’une biopsie de gros volume [1]. Le traitement des tumeurs desmoides n’est pas codifié, il comprend plusieurs modalités afin de prévenir le risque de récidive : (1) la chirurgie d’exérèse large de la tumeur si possible tout en respectant les éléments nobles et en acceptant les récidives et les ré-interventions [14]. En cas d’une perte de substance importante, une reconstruction pariétale peut être réalisée en utilisant un matériel prothétique ou un tissu autologue [15-17]; (2) La radiothérapie peut être proposée chez les patients inopérables ou en complément d’une exérèse incomplète pour récidive [18-19] (le cas de nos deux patients); (3) Tous les autres moyens thérapeutiques non chirurgicaux (antimitotiques, anti-estrogènes, modulateur de l’AMP cyclique, inhibiteurs des prostaglandines) n’ont pas encore fait la preuve de leur efficacité mais restent cependant d’intérêt académique et d’avenir [8].
Les récidives surviennent en moyenne dans 50% des cas ; plusieurs facteurs prédictifs de récidive ont été rapportés dans la littérature [1] à savoir : l’âge jeune inférieur à 30 ans, le sexe féminin, la localisation (les récidives sont plus fréquentes au niveau des extrémités), la qualité des marges d’exérèse: le risque de récidive est de 27% si les marges de résection sont histologiquement saines contre 54% si elles sont envahies. Dans notre expérience, nous pensons que le principal facteur prédictif de la récidive est l’envahissement profond de la paroi thoracique ainsi que la positivité des marges de résection.
La chirurgie reste le traitement de choix des tumeurs desmoides mais des rechutes locales peuvent survenir dans un tiers des cas. Un suivi post opératoire à long terme est nécessaire [20] ; en effet des récidives tardives peuvent survenir même si la résection a été complète et ce probablement à partir d’un nodule de perméation.
Les auteurs déclarent n’avoir aucuns conflits d’intérêts
1. Mignot L. Les tumeurs desmoïdes. Orphanet encyclopédie, janvier 2002.
2. Shields CJ, Winter DC, Kirwan WO, Redmond HP. Desmoid tumours. Eur J Surg Oncol 2001;27:701-706.
3. Mendez-Fernandez M, Gard DA. The desmoid tumors: benign neoplasm, not a benign disease. Plastic Reconstr Surg 1991;87:956-960.
4. Cotte E, Glehen O, Monneuse O, Cotton F, Vignal J. Tumeurs desmoïdes associées à la polypose adénomateuse familiale. Gastroenterol Clin Biol 2004;28: 574-581.
5. Wilcken N, Tattersall MN. Endocrine therapy of desmoid tumors. Cancer 1991;68:1384-1388.
6. Kaplan J, Davidson T. Intrathoracic desmoids: report of two cases. Thorax 1986;41:894-95.
7. Bridge JA, Sreekantaiah C, Mouron B, Neff J, Sandberg AA, Wolman SR. Clonal chromosomal abnormalities in desmoid tumors: Implications of histopathogenesis. Cancer 1992;69:430-436.
8. David W, Easter MD, Nicholas A, Halasc MD. Recent Trends in Management of Desmoïd Tumours. Summary of 19 cases an Review of the Literature. Ann. Surg. 1989, 210, n°6, 765-769.
9. Thene M, Thevenot J, Monrozies X, Fournie A. Tumeurs desmoïdes de la paroi abdominale antérieure. A propos d’une observation. Ann. Chir., 1989, 43, n°4, 295-298.
10. Camiel MR, Solish GI. Desmoïd tumour during pregnancy. Am. J. Obstet. Gynecol., 1982, 144, 988-989.
11. Tourne Y, Saragaglia D, Butel J. Les fibromes desmoïdes des parties molles à localisation extra-abdominale : revue de la littérature à propos d’un cas situé à la face postérieure de la cuisse. Ann. Chir., 1989, 43, n°4, 289-294.
12. Chevrel JP, Sarfati E, Sagier J, Kemeny JL. Tumeur desmoïde et syndrome de Gardner, à propos d’une observation. J. Chir. (Paris) 1983, 120, 159-164.
13. L Montagliani, V Duverger. Les tumeurs desmoïdes. J Chir 2008,145, N°1.
14. Souma T, Hirono T, Yamato Y, Yoshiya K, Nakayama K, Tsuchida M, Eguchi S. Surgical management of desmoid tumors of the chest wall: a case report and review of literature. Kyobu Geka 1992;45(9):823-826.
15. Allen PJ, Shriver CD. Desmoid tumors of the chest wall. Semin Thorac Cardiovasc Surg 1999;11(3):264-269.
16. Kawamura M, Seki M, Yoshizu A, Naruke M, Yamahata J, Izumi Y, Eguchi K, Horinouchi H, Kato R, Kikuchi K, Kobayashi K. Reconstruction of chest wall defects with autogenous ribs grafts. Kyobu Geka 1996;49(1):53-56.
17. Kao CC, Rand RP, Stridde BC, Marchioro TL. Techniques in the composite reconstruction of extensive thoracoabdominal tumor resections. J Am Coll Surg 1995;180(2):146-149.
18. Sherman NE, Romsdahl M, Evans H, Zagars G, Oswald MJ. Desmoid tumors: a 20-years radiotherapy experience. J Radiat Oncol Biol Phys 1990;19(1):37-40.
19. Dale PS, Wardlaw JC, Wootton DG, Resnick JI, Giuliano AE. Desmoid tumor occurring after reconstruction mammaplasty for breast carcinoma. Ann Plast Surg 1995;35(5):515±518.
20. Tsuchishima S, Nishizawa H, Matsumoto Y, Kitagawa S, Shimizu T, Yuasa K. A desmoid tumor of the chest wall. Kyobu Geka 1998;51(12):1055-1059.