Localisation humérale d’une tumeur à cellules géantes récidivantes (à propos d’un cas)
Youssef Nader, Issam Serghini, Idrissi Khalid Koulali, Hicham Salahi, Farid Galwia
Corresponding author: Nader Youssef, Pôle de Traumatologie et Orthopédie, Hôpital Militaire Avicenne, Marrakech, Maroc 
Received: 30 Sep 2014 - Accepted: 25 Nov 2014 - Published: 05 Jan 2015
Domain: Clinical medicine
Keywords: Cas rare, interessant, recidivant, agressif, difficulté therapeutique
©Youssef Nader et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Youssef Nader et al. Localisation humérale d’une tumeur à cellules géantes récidivantes (à propos d’un cas). Pan African Medical Journal. 2015;20:12. [doi: 10.11604/pamj.2015.20.12.5519]
Available online at: https://www.panafrican-med-journal.com//content/article/20/12/full
Original article 
Localisation humérale d’une tumeur à cellules géantes récidivantes (à propos d’un cas)
Localisation humérale d’une tumeur à cellules géantes récidivantes (à propos d’un cas)
Youssef Nader1,&, Issam Serghini2, Idrissi Khalid Koulali1, Hicham Salahi1, Farid Galwia1
1Pôle de Traumatologie et Orthopédie, Hôpital Militaire Avicenne, Marrakech, Maroc, 2Pôle d’Anesthésie-Réanimation, Hôpital Militaire Avicenne, Marrakech, Maroc
&Auteur correspondant
Nader Youssef, Pôle de Traumatologie et Orthopédie, Hôpital Militaire Avicenne, Marrakech, Maroc
Les auteurs rapportent un cas de localisation rare d'une tumeur à cellules géantes au niveau de la palette humérale du coude droit chez un militaire de 36 ans de sexe masculin, la radio standard montrait une image kystique ne soufflant pas la corticale. L'examen anatomo-pathologique a permis d' établir le diagnostic et le traitement a fait appel: au début a une Exérèse chirurgicale totale et une greffe osseuse par un greffon iliaque de la totalité de la palette huméral qui s'est compliquée à 6 mois de recule d une récidive locale.
Les tumeurs à cellules géantes sont des tumeurs fréquentes ; de comportement souvent déroutant, très récidivantes souvent bénignes et se localisant, la plus part du temps, aux extrémités des os longs des membres. La localisation distale de l'humérus est une entité rare. Leur traitement est presque exclusivement chirurgical mais non univoque. A propos d'un cas de localisation huméral exclusive, traitée chirurgicalement par résection et autogreffe, les auteurs insistent sur la rareté de cette localisation et sur la fréquence de ses récidives et proposent d'en faire une revue de littérature.
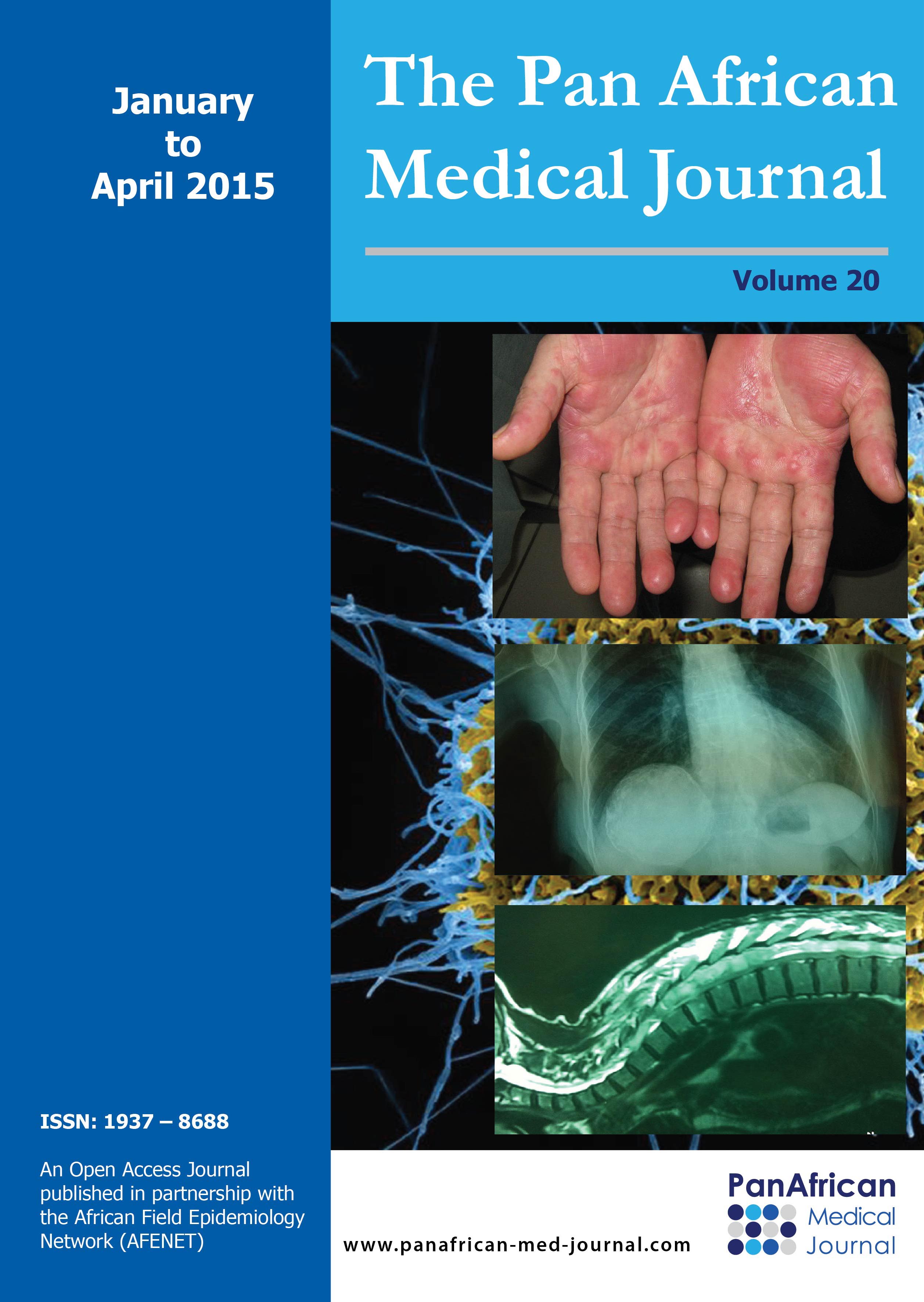
Un patient âgé de 36 ans, de sexe masculin, militaire, sans antécédents pathologiques particuliers, consulte pour une tuméfaction de la face dorsale du coude droit, évoluant depuis un an et augmentant progressivement de volume, elle est douloureuse à la palpation, sans signes inflammatoires locaux, ni signes compressifs vasculaires ou nerveux. La radio standard montrait une image kystique ostéolytique pure, soufflant les corticales à bords flous, sans envahissement des parties molles (Figure 1). Le bilan biologique était sans particularité. Les signes cliniques, l'aspect radiologique et la localisation de la tumeur oriente vers le diagnostic de Chondrome. L'examen anatomo-pathologique après abord chirurgical postérieur électif a permis de poser le diagnostic de tumeur à cellules géantes. Le traitement consistait en un curetage de la tumeur qui avait détruit presque la totalité de la palette humérale, associé à une greffe osseuse corticospongieuse comblant le vide sur la totalité de l'épiphyse distale de l'humérus. Le greffon est prélevé au dépend de la crête iliaque homo latérale. L évolution après un recul de six mois était marqué par une récidive locale.
Les tumeurs à cellules géantes ou tumeurs à myeloplax sont des lésions ostéolytiques; de siège habituellement épiphysaire. Elles sont constituées d'un double contingent cellulaire: cellules géantes et éléments mononuclées. Ce sont des tumeurs peu fréquentes représentant en général 5 à 10/% des tumeurs primitives des os. souvent bénignes, elles constituent 13 à 15% des tumeurs bénignes des os. Mais elles peuvent parfois être malignes et représentent 2 à 5% des tumeurs malignes primitives de l'os. Les tumeurs à cellules géantes malignes constituent environ 10% de l'ensemble des tumeurs myeloplax [1-3]. Elles surviennent le plus souvent avec légère prédominance féminine entre 20 à 40 ans sur un os préalablement normal. Elles se localisent préférentiellement aux extrémités des os longs des membres (80 à 90% des cas) prés du genou, loin du coude (avec 60% au niveau du genou) [1-3]. Les extrémités distales de l'humérus, du cubitus, du radius et du péroné sont de sièges rares. Les métacarpes les phalanges représentent une localisation très rare avec moins de 1% de l'ensemble des localisations. L'atteinte des os courts et du tronc est moins habituelle surtout pour la rotule, le calcanéum, les os du carpe et du tarse [4]. Enfin, les formes multiples sont très exceptionnelles avec moins de 1% [2,3]. Le tableau découverte d une tuméfaction qui alerte le patient, comme le cas de notre patient, En fin les facteurs pathologiques inaugurales sont possibles [5-7]. Le bilan biologique est souvent normal, cependant un bilan phosphocalcique est demandé; pour écarter une hyperthyroïdie. Quand à l'imagerie, dans la plus part des cas; de bonnes radiographies standards suffisent au diagnostic et permettent d'entreprendre le traitement ; L'image de base est celle d une ostéolyse qui peut être pure ou en nid d'abeilles selon l'agressivité de la tumeur [8]. Un examen tomodensitométrie ou une étude en résonance magnétique peuvent être utiles si l'on craint un envahissement des paries molles [8].La scintigraphie n'est utile que dans le dépistage des récidives. L'artériographie embolisante s'avère nécessaire dans les localisations difficiles (rachis, sacrum). Devant une localisation habituelle, les radiographies doivent faire discuter: un chondroblastome; un kyste anévrysmal ou une localisation épiphysite des chondrosarcomes à cellules claires. Dans les autres localisations la discussion est plus difficile, mais en règle et dans tous les cas c'est la biopsie seule qui permettra, de trancher un diagnostic positif, de préciser les éléments d évolutivités de la tumeur et d'identifier éventuellement sarcome [3,5,6,8]Cependant des pièges de diagnostic histologique peuvent toujours se poser et nécessitent dans certains cas, une approche morphologique par techniques [9]; (ultra structurales, histochimie analyses imminohistochimie, histoenzymologie et auto historadiographie: marquage par un anticorps monoclonal permettant d'isolé les phases actives du cycle cellulaire, exemple anticorps monoclonal Ki -67).
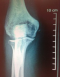
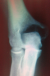
La classification histologique de 1940, de Jaffé-Lichtenstein[10] a un intérêt thérapeutique et pronostique, et propose le schéma suivant qui distinguent trois situations: Grade1: abondance de cellules géantes par rapport au contingent mononuclée, absence d'anomalies nucléaires à ce niveau, mitoses rares. Ce sont des tumeurs bénignes: histologiquement tranquilles. Grade 2: cellules mononuclées abondantes, discrètes anomalies nucléaires, activité mitotique marquée, mais sans formes atypiques. Ce sont tumeurs bénignes histologiquement actives Grade 3: c'est la cytologie et l'architecture d'un sarcome maligne. La TCG de notre patient est classé selon cette classification: grade 2 Senerkin, en1980 suggère une classification différente: Degré 1: il regroupe les TCG habituelles (grade 1, 2 de la classification: JafféL-Lichtenstein) . Degré 2: ce sont des tumeurs borderline (grade 2 et plus). On y identifie des mitoses anormales Degré 3: ce sont des sarcomes avérés. D'autres classifications ont été proposées: celle de Merle Aubigné, et celle: Campanacci basées sur les aspects radiologiques et celle de Enneking [11] propose une autre qui prend en compte le comportement biologique global de la tumeur. L évolution de ces tumeurs est marqué par la fréquence des récidives (30%) qui peut être locales ou dans les parties molles. Elles surviennent dans les 3 premières années, mais sont possibles jusqu'à la 10éme année [12]. Chez notre patient et après un recul de six mois nous avons détecté malheureusement une récidive locale (Figure 2). Cependant, une dégénérescence maligne peut également se voir. Elle peut être spontanée au fil des récidives ou radio induite. Mais elle peut également survenir sur des formes ou il existait dés le départ des zones malignes, parfois petites et ayant été méconnues lors de biopsies trop économiques [13]. D'ou l'intérêt de faire de la première biopsie un véritable temps de curetage-comblement, les récidives doivent également être rebiopsié avant de décider du nouveau traitement. Enfin des métastases pulmonaires bénignes peuvent également apparaître dans l'évolution d'une tumeur à cellules géantes bénigne. Le traitement est souvent chirurgical [14-18], intra lésionnel: avec curetage simple, curetage comblement classique par greffe osseuse; curetage comblement avec adjuvants (azotes liquide, eau distillée, phénol, ciment chirurgical); ou extra lésionnel: avec résection marginale et reconstruction, résection large ou amputation. Parfois d'autres procédés thérapeutiques peuvent être utilisées: embolisation, injection journalière intra tumorale de calcitonine; radiothérapie ou chimiothérapie. Les tumeurs malignes bénéficient, de 2 à 3 mois de chimiothérapie, suivi d'une résection reconstruction le plus souvent et très rarement d'une amputation; si envahissement des parties molles, avec reprise de chimiothérapie de 4 à 6 mois en postopératoire [15, 16, 18]. Les métastases pulmonaires bénignes sont réséquées par thoracotomie chaque fois que possible. Les tumeurs bénignes récidivantes font souvent l'objet d'une seconde biopsie de confirmation et d'un second curetage avec comblement adjuvante le plus souvent on utilise du ciment chirurgical, ce qui a été réalisé chez notre patient complété par une ostéosynthèse par une plaque lecéstre (Figure 3).
La localisation humérale distale des tumeurs à cellules géantes et rares. L'aspect radiologique fait penser aux tumeurs bénignes: chondromes; chondroblastome. Le diagnostic positif est purement histologique et le traitement est chirurgical: résection-greffe ou résection-comblement en cas de récidive bénigne.
Les auteurs ne déclarent aucun conflit d'intérêts.
Tous les auteurs ont contribué à la conduite de ce travail. Tous les auteurs déclarent également avoir lu et approuvé la version finale du manuscrit.
Figure 1: RX standards: tumeur a cellules géantes
Figure 2: 1er récidive après curetage+greffe corticospongieuse
Figure 3: traitement de la 1ère récidive: curetage+comblement au ciment+ostéosynthèse
- M Boufiglio, CJ Campell, RJ Goldenberg. Giant cell tumor of bone (analysis 218 cas). J Bone Joint Surg Am. 1970 Jun; 52(4):619-664. PubMed | Google Scholar
- DC Dahlin, DJ Mc Donald, RA Mc Led, F H Sim. Giant cell tumor of bone. J Bone joint Surg Am. 1986 Feb; 68(2):235-242. PubMed | Google Scholar
- N Beldini, S Boriani et coll, M Campanacci. Giant cell tumor of bone Joint. Surg Am. 1987 Jan; 69(1):106-14. PubMed | Google Scholar
- RG Swee, LE Wob. Giant cell tumor of the smail bones of the hand and feet. Semin Diagn Patho. 1984 Aug; 1(3):173-84. PubMed | Google Scholar
- L Boquist, J E Larson, R Lorentzon. Giant cell tumor of bone a demographic, clinica and histologica Study of all case recorded in the Swedish cancer registry for the years 1958 the rough 1968. J Bone Joint surg Am. 1975 Mar; 57(2):167-173. PubMed | Google Scholar
- R Meary, D Aubigne, Bitomino, L Sedel. Tumeur à cellules géantes 85 observation suivies. Rev chir orthop. 1975; 61:391-413. PubMed | Google Scholar
- L Sedel. Les tumeurs à cellules géantes des os (à propos d une série homogène de 74 cas) Thèse de Med. Université 2 Cochin-Port Royal Paris. 1973. Google Scholar
- F Bertoni, T Hudson et Coll, D Present.The correlation between the radiologic staging studies and histopathologic findings in aggressive stage 3giant cell tumor of bone. Cancer. 15 January 1986; 57(2):237-244. PubMed | Google Scholar
- D B Basewitz, A Roessner, W Schiake et Coll. Giant cell tumor of bone: a combined electron microscopial histochimical and autoradiograph cal study. Pathol Res Pract. 1984 May;178(5):431-40. PubMed | Google Scholar
- H L Jaffe, L Lichtenstein, R N Portis. Giant cell tumor of bone Ist pathological appearance, grinding, supposed variants and treatment. Arch Patho. 1940; 30:993-1031. PubMed | Google Scholar
- Z F Enneking. A system of staging for musculoskeletal neoplasms. Clinic Orthop. 1986; 204:9-24. PubMed | Google Scholar
- N G Sanerkini. Maligancy, aggressiveness and recurrence in giant cell Tumor of bone. Cancer. 1980; 46(7):1641-1649. PubMed | Google Scholar
- D J Pritchard, M GRock, K Unni. Metastases from histologically Benign giant cell tumor of bone. J Bone Joint Surg Am. 1984 Feb;66(2):269-74. PubMed | Google Scholar
- E U Conrad, D Glasser, A Huvos, J M Lane, R Marcove. Giant cell tumors treated with curetage and cryosurgery (110 cas). J Bone Surg. Mars1990; 72B: 937. PubMed | Google Scholar
- E U Conrad, W F Enneking, D S Springfield. Giant cell tumoral treated with and cimemtation limb salvage in musculoskeletal oncology. New York, Churchill Livingstone. 1987; 516. PubMed | Google Scholar
- EMSOS 89. Symposium annuel de l'Europe an Musculoskelettal Oncology Society. Institut Rizzoli de Bologne. Table ronde sur le curetage-comblement des TCG bénignes des membres (dirigée par Capanna, institut Rizzoli). Sept 1989. PubMed | Google Scholar
- J Johnston. Giant cell tumor of bone: the role of the giant cell in orthopedic pathology. Orthop Clin North Am. 1977; 8(4):751-770. PubMed | Google Scholar
- D Hammouch, A Mazarboud, R Merle Daubigny, J M Thomine. Evolution spontanée et postopératoire des TCG (indications thérapeutiques à propos de 39 cas dont 2O suivis cinq ans ou plus). Revu Chir Orthop. 1954; 8:689-714. PubMed | Google Scholar