La tumeur testiculaire du sac vitellin: une entité rare chez l’adulte
Mohammed Alami, Abdellatif Janane, Mohamed Abbar, Ahmed Ameur, Mohamed Ghadouane
Corresponding author: Mohammed Alami, Service d'Urologie de l'Hôpital Militaire Universitaire Mohamed V, Rabat, Maroc 
Received: 29 Mar 2014 - Accepted: 03 May 2014 - Published: 24 May 2014
Domain: Clinical medicine
Keywords: Tumeur du sac vitellin, chimiothérapie, suivi, pronostic
©Mohammed Alami et al. Pan African Medical Journal (ISSN: 1937-8688). This is an Open Access article distributed under the terms of the Creative Commons Attribution International 4.0 License (https://creativecommons.org/licenses/by/4.0/), which permits unrestricted use, distribution, and reproduction in any medium, provided the original work is properly cited.
Cite this article: Mohammed Alami et al. La tumeur testiculaire du sac vitellin: une entité rare chez l’adulte. Pan African Medical Journal. 2014;18:80. [doi: 10.11604/pamj.2014.18.80.4270]
Available online at: https://www.panafrican-med-journal.com//content/article/18/80/full
La tumeur testiculaire du sac vitellin: une entité rare chez l’adulte
Mohammed Alami1,&, Abdellatif Janane1, Mohamed Abbar1, Ahmed Ameur1, Mohamed Ghadouane1
1Service d'Urologie de l'Hôpital Militaire Universitaire Mohamed V, Rabat, Maroc
&Auteur correspondant
Mohammed Alami, Service d'Urologie de l'Hôpital Militaire Universitaire Mohamed
V, Rabat, Maroc
La tumeur testiculaire du sac vitellin pure est rare chez l'adulte. Son diagnostic est histologique, elle reproduit une structure extra-embryonnaire (le tissue du sinus endodermique). Son traitement est codifié. Le pronostic est moins bon chez l'adulte. Nous en rapportons un cas et nous discutons l'histogénèse, les attitudes thérapeutiques, le suivi et le pronostic chez l'adulte.
La tumeur testiculaire de sac vitellin est une variante histologique des tumeurs germinales non séminomateuses (TGNS). Cette entité est peu fréquente chez l'enfant (<2,5% des TGNS), elle reste exceptionnelle chez l'adulte [1, 4]. Dans son stade métastatique, le traitement est codifié (orchidectomie inguinale suivie d'une chimiothérapie en 03 ou 4 cycles selon le groupe pronostique). Nous en rapportons un cas chez l'adulte.
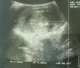
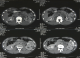
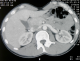
Mr R. M, était âgé de 22 ans, sans antécédent notable. Il était admis pour une grosse bourse gauche, indolore qui évoluait depuis plus de 06 mois, dans un contexte de conservation de l'état général et d'apyrexie. A l'examen clinique, il y a avait une masse testiculaire gauche dure, ferme, irrégulière, indolore de 5cm de grand axe et sans envahissement de l'épididyme. Le reste de l'examen était normal A l'échographie scrotale : une masse testiculaire gauche hétérogène hypoéchogène de 62mm/40mm de diamètre (Figure 1). L'alpha foetoprotéine (AFP) était > 230 fois la normale (6900ng/ml). Sur la TDM pelvi-abdomino-thoracique, elle y avait une lésion ganglionnaire hypodense de 5cm de diamètre, au dessus de l'artère rénale gauche prenant le contraste de façon hétérogène (Figure 2).
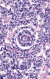
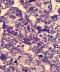
Le patient avait eu une orchidectomie inguinale gauche. L'histologie était en faveur d'une tumeur pure du sac-vitellin, sans effraction albuginéale (Figure 3, Figure 4). Trois semaines plus tard, le patient était revu en consultation avec des AFP toujours élevées à 284ng/ml (< 10 fois la normale). Une chimiothérapie était instaurée : 04 cycles de (Bléomycine 30mg- Etoposide 120mg/m²- Cisplatine 20mg/m²) BEP.
Trois mois plus tard : l'AFP était normale, la TDM de contrôle montrait une régression complète de la lésion sus pédiculaire rénale gauche (Figure 5). Le recul actuel est de 05 ans, le patient est en rémission complète.
La tumeur du sac vitellin est une variante histologique peu fréquente des TGNS de l'adulte. Chez 'enfant de moins de 05 ans, elle est présente sous forme mixte sur les (2,5%) des pièces d'orchidectomie, réalisées pour cancer testiculaire [1, 2]. La forme pure, décrite chez l'enfant, reste exceptionnelle chez l'adulte. Plus de 79% des formes publiées chez l'adulte sont associées à d'autres contingents de TGNS [1, 2].
Cette tumeur différenciée dans le sens extra-embryonnaire, reproduisant histologiquement la structure du sac vitellin de l'homme (sinus endodermique du rat), exprime constamment à l'immuno-histochimie l'AFP. En revanche, l'élévation de l'AFP dans le sang dépend du stade pathologique du cancer [2, 3].
Des tumeurs du sac vitellin sans sécrétion d'AFP dans le sang ont été décrites. Dans le travail de Flamant : 30 à 40% des tumeurs du sac vitellin (PT1 N2 M0) ne sécrètent pas d'AFP [2]. Ce marqueur, ne pouvant pas être recommandé ni pour le dépistage ni pour le diagnostic des tumeurs primitives ou de la nature des masses résiduelles, aurait surtout une valeur dans le suivi post thérapeutique.
Macroscopiquement, cette tumeur souvent kystique présente des plages molles mucoïdes [4, 5]. L'architecture glandulaire de cette tumeur est loin d'être uniforme. Les formes lâches, kystiques ou tubulaires peuvent poser des problèmes de reconnaissance. Les corps de Schiller- Duval (formations périvasculaires gloméruloïdes) reproduisant des éléments typiques du sinus endodermique du placenta, ainsi que les globules éosinophiles intra et extracellulaires sont fondamentaux pour retenir ce diagnostic. L'anisocaryose est marquée, le cytoplasme est granuleux exprimant de façon constante d'AFP. [1, 5]
Le traitement de cette TGNS, au stade PT1N3S2M0, est actuellement codifié reposant sur 4 cycles de BEP. Un bilan de réévaluation, 04 semaines après le dernier cycle, est recommandé [2, 6]: si les marqueurs restent élevés : 4 cycles de Vinblastine- Ifosfamide (Ve-IP) ; Quand les marqueurs se normalisent, mais des masses résiduelles restent visibles en TDM, un curage rétro péritonéal s'impose. La présence de tissu actif dans ces masses résiduelles nécessite 02 cycles de Ve-IP.
Dans notre observation, le malade était classé PT1N3S2, il avait eu 04 cycles de BEP : Bléomycine 30mg (J2, J9, J16) ; Etoposide 120mg/m² (J1, J3, J5) ; Cisplatine 20mg/m² (J1, J5).
La normalisation de l'AFP, la régression de la lésion latéro-aortique gauche était constatées au 3ème mois post chimiothérapie. Le recul actuel est de 05 ans. La probabilité de rechute ou de récidive de la maladie à 05 ans chez notre patient est de 25 à 35% selon le dernier rapport de l'AFU de 2007 [6]. Une chimiothérapie de 2ème ligne (4 cycles Ve-IP) s'imposerait en cas de réascension d'AFP chez notre patient. La chirurgie d'éventuelles masses résiduelles pourrait être licite, dans la mesure où il n'existe de critères prédictifs de la nature histologique de ces masses. Le PET scan au 18 FDG, utile dans le suivi des séminomes, n'a pas de place dans le bilan de réévaluation des masses résiduelles en cas de TGNS [7,8]. La persistance de tissu tumorale actif sur l'analyse histologique des masses rétropéritonéales d'exérèse, récente une chimiothérapie complémentaire à base de 2cycles de Ve-IP [3, 8].
La tumeur testiculaire du sac vitellin est exceptionnelle chez l'adulte. Son pronostic est moins bon que celui de l'enfant. Sa découverte, à un stade métastatique chez l'adulte, fait appel à un traitement agressif multidisciplinaire (chimiothérapie, curage ganglionnaire, exérèse des masses résiduelles post chimiothérapie). L'évolution de cette tumeur dépend du groupe pronostic du malade, au moment du diagnostic.
Les auteurs ne déclarent aucun conflit d'intérêts.
Tout les auteurs en contribuer à l'élaboration de ce travail: soit par le diagnostique, le traitement, le suivi, ainsi que la discussion et la revue de la littérature.
Figure 1: masse testiculaire hypoéchogène hétérogène gauche de 6,23 cm/ 4 cm de diamètre
Figure 2: lésion ganglionnaire latéroaortique gauche hypodense rehaussée après injection de produit de contraste
Figure 3: structures gloméruloïdes (Corps de Schiller-Duval) au sein d’une différentiation glandulaire. Anisocaryose marquée, activité mitotique élevée
Figure 4: travées et structures labyrinthiques glandulaires, comportant des globules éosinophiles typiques du sac vittelin
Figure 5: TDM de contrôle trois mois après chimiothérapie montrant la régression de la lésion ganglionnaire latéroaortique gauche
- Debbagh A , Bennani S , Jouhadi H , Joual A, Mrini M EL, Kahlain A, Benjelloun S. Tumeur de sac vitellin : à propos d'un cas. Ann Urol. 2001; 35(6):356-358. PubMed | Google Scholar
- Flamant F, Nihoul-Fekete C, Lemerle J. Optimal treatment of clinical stage I Yolk Sac Tumour of the testis. J Paediatric Surgery. 1986; 21(2): 108-111. PubMed | Google Scholar
- Hotte SJ, Jewett M, Chin J. Management of stage I Non seminomatous testicular cancer. Clin Oncol. 2010 Feb; 22(1): 17-26. PubMed | Google Scholar
- Foster RS, Hermans B, Bihrle R, Donohue JP. Clinical stage I pure Yolk sac tumour of the testis in adult has different clinical behaviour than juvenile Yolk sac tumour. J Urol . 2000 Dec ; 164 (6) : 1943-194. PubMed | Google Scholar
- Jonathan HR. Pre pubertal testicular tumours. Urology. 2009 Jul; 74 (1): 94-99. PubMed | Google Scholar
- Culine S. Prise en charge des tumeurs germinales non séminomateuses de stade I après orchidectomie, comité de cancérologie de l'AFU. Progrès Urol. 2007; 17 : 1035-1045. PubMed | Google Scholar
- Schmoll HJ, Souchon R, Krege S et al. European consensus on diagnostic and treatment of germ cell cancer. Ann Oncol. 2004(Sep); 15 (9): 1377-1399. PubMed | Google Scholar
- Culine S, Kerbrat P, Kramar A. Refining the optimal the optimal chemotherapy regimen for good risk metastatic non seminomatous germ cell tumours. Ann Oncol. 2007 May; 18(5): 917-924. PubMed | Google Scholar